题目内容
【题目】(1)某强酸性溶液X可能含有A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-中的一种或几种,取该溶液进行连续实验,实验过程如下:
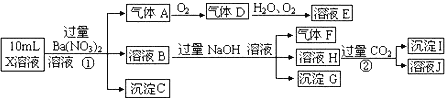
根据以上信息,回答下列问题:
上述离子中,溶液X中除H+外还肯定含有的离子是__________
请设计简单的实验检验不能确定是否含有的离子(若不止一种,可任选一种)的存在:
写出反应①的离子方程式 ;
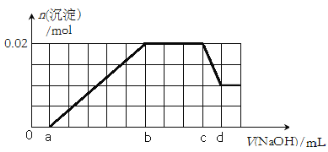
④假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有 .
(2)实验室常见的几种气体发生装置如图A、B、C所示:
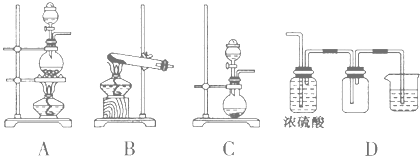
①实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为 。
②气体的性质是选择气体收集方法的主要依据.下列气体的性质与收集方法无关的是 (填序号,下同).
A.密度 B.颜色 C.溶解性 D.热稳定性 e.与氧气反应
③若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的 (填序号).
A.CO2 B.NO C.Cl2 D.H2 e.HCl
其中在D装置中连接烧杯的目的是
【答案】(1)①Al3+、NH4+、Fe2+、SO42-
②取少量X溶液于试管中,加入几滴KSCN溶液,若溶液变红色则说明有Fe3+,反之则无Fe3+(或取少量B溶液于试管中,加入几滴AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)(或取少量X溶液于试管中,滴加Ba(NO3)2溶液至不再产生沉淀,再取上层清液于另一试管向其中滴加AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-)
③3Fe2++4H++NO3—=3Fe3++NO↑+2H2O、Ba2++SO42-=BaSO4↓④Fe3+
(2)①2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O②bd③c,尾气处理
CaCl2+2NH3↑+2H2O②bd③c,尾气处理
【解析】
试题分析:强酸性溶液X中不可能存在与氢离子发生离子反应的离子,所以CO32-、SO32-一定不存在;加入硝酸钡溶液有气体产生,所以该溶液中存在与硝酸发生氧化还原反应的离子Fe2+,气体A是NO,因为不存在CO32-、SO32-,所以一定存在SO42-;沉淀C是硫酸钡沉淀;溶液B中含有硝酸钡、硝酸铁等,加入过量氢氧化钠溶液,有气体产生,则原溶液中一定存在NH4+;氢氧化钠与硝酸铁反应生成沉淀氢氧化铁,所以G中一定含有氢氧化铁;溶液H中通入过量二氧化碳,与溶液中的氢氧根离子、钡离子反应生成的是碳酸氢钡,所以产生的沉淀一定有氢氧化铝沉淀,所以原溶液中一定含有Al3+。
(1)①根据以上分析,该溶液中一定存在的是Al3+、NH4+、Fe2+、SO42-;
②铁离子与氯离子不能确定,证明铁离子是否存在,取少量X溶液于试管中,加入几滴KSCN溶液,若溶液变红色则说明有Fe3+,反之则无Fe3+;证明氯离子是否存在,取少量B溶液于试管中,加入几滴AgNO3溶液,若有白色沉淀则说明有Cl-,反之则无Cl-;
③反应①是硝酸与亚铁离子的氧化还原反应,离子方程式是3Fe2+ + 4H++ NO3—=3Fe3++NO↑+2H2O,同时还有硫酸钡沉淀产生,方程式为Ba2++SO42- =BaSO4 ↓;
④A、F、I均为0.1mol,说明NO的物质的量是0.1mol,则溶液中Fe2+ 的物质的量是0.3mol,铵根离子的物质的量是0.1mol,铝离子的物质的量是0.1mol,沉淀C的物质的量大于0.7mol也即硫酸根离子的物质的量大于0.7mol,根据电荷守恒,n(H+)+ 3n(Al3+)+ n(NH4+)+2 n(Fe2+)<2n(SO42-),所以该溶液中一定存在Fe3+;
(2)①采用B装置制备氨气时应选择用氢氧化钙和氯化铵固体加热反应,化学反应方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②选择气体收集方法,不需要考虑气体颜色和热稳定性,依据气体密度,是否与空气中的氧气反应来选择排空气方法收集,依据气体是否溶于水判断收集气体是否能用排水方法或排其他液体的方法,故答案为bd;
③AD连接是利用向上排气法收集气体;吸收装置是能用液体吸收气体防止污染空气;制取CO2时不需要加热也不不必处理尾气,NO常温下与氧气发生反应,不能用向下排空气法收集,氢气尾气处理时一般采用点燃的方法,制取HCl一般不需要加热,故X可能是氯气;D装置中连接烧杯的目的是用来吸收尾气,防止污染空气。