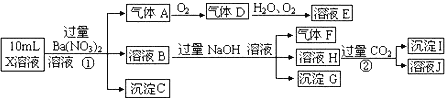
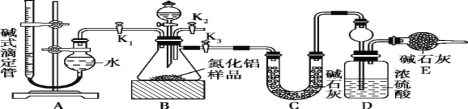
题目内容
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
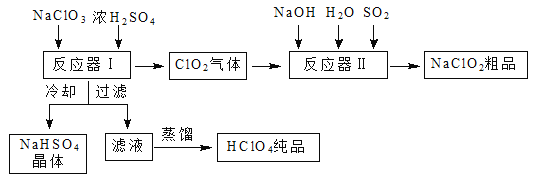
已知:① NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
② 高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,请写出工业上生产漂白粉的离子方程式: 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为 。(结果保留两位小数)
【答案】(1)3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O(2分)
降低NaHSO4的溶解度,使NaHSO4结晶析出(2分)
(2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O(2分)
(3)H2O2有还原性也能把ClO2还原为NaClO2(2分)
(4)Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O(2分)2.63(2分)
【解析】
试题分析:(1)观察工艺流程图可知,反应器Ⅰ中主要反应物为NaClO3 、H2SO4,主要生成物为HClO4 、ClO2 、NaHSO4 ,只有氯元素化合价发生升降,属于歧化反应,由最小公倍数法、原子守恒法逆向配平可得:![]() ;由已知信息中“NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出”可知,冷却的主要目的是降低NaHSO4的溶解度,使NaHSO4结晶析出;(2)读图可知,反应器II中主要反应物为ClO2 、NaOH、SO2 ,主要生成物为Na2SO4、NaClO2,氯元素降价,硫元素升价,由最小公倍数法、原子守恒法逆向配平可得:
;由已知信息中“NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出”可知,冷却的主要目的是降低NaHSO4的溶解度,使NaHSO4结晶析出;(2)读图可知,反应器II中主要反应物为ClO2 、NaOH、SO2 ,主要生成物为Na2SO4、NaClO2,氯元素降价,硫元素升价,由最小公倍数法、原子守恒法逆向配平可得:![]() ;(3)双氧水中氧元素的化合价为-1价,是氧元素的中间价态,遇强氧化剂时能表现还原性,因此H2O2也能把ClO2还原为NaClO2;(4)工业上常用石灰乳吸收氯气的方法制备漂白粉,即2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,石灰乳中可以看到白色沉淀,因此Ca(OH)2不能拆写成离子,只有易溶且完全电离的CaCl2、Ca(ClO)2能拆写,由此可得:Cl2 + Ca(OH)2 = Ca2+ + Cl- + ClO- + H2O ;设1 g ClO2的氧化能力相当于x g Cl2的氧化能力,含氯消毒剂消毒时均转化为-1价氯离子,由此可得它们得电子关系式分别为ClO2~Cl-~5e-、Cl2~2Cl-~2e-,1 g ClO2的氧化能力(即得电子的量)为
;(3)双氧水中氧元素的化合价为-1价,是氧元素的中间价态,遇强氧化剂时能表现还原性,因此H2O2也能把ClO2还原为NaClO2;(4)工业上常用石灰乳吸收氯气的方法制备漂白粉,即2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,石灰乳中可以看到白色沉淀,因此Ca(OH)2不能拆写成离子,只有易溶且完全电离的CaCl2、Ca(ClO)2能拆写,由此可得:Cl2 + Ca(OH)2 = Ca2+ + Cl- + ClO- + H2O ;设1 g ClO2的氧化能力相当于x g Cl2的氧化能力,含氯消毒剂消毒时均转化为-1价氯离子,由此可得它们得电子关系式分别为ClO2~Cl-~5e-、Cl2~2Cl-~2e-,1 g ClO2的氧化能力(即得电子的量)为![]() mol,x g Cl2的氧化能力(即得电子的量)为
mol,x g Cl2的氧化能力(即得电子的量)为![]() mol,
mol,![]() =
=![]() ,解得:x≈2.63。
,解得:x≈2.63。