题目内容
【题目】(10分)离子推断题:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量的BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,称量沉淀质量为6.99g;
②第二份逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如下图所示。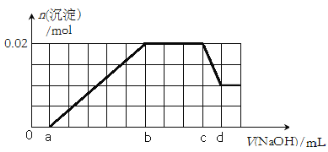
根据上述实验事实,回答以下问题:
(1)该溶液中一定不存在的阳离子有 ;
(2)在实验②中,NaOH溶液滴至b~c段过程中发生的离子反应方程式为 ;NaOH溶液的浓度为 (用含字母c、d的代数式表示);
(3)确定原溶液一定含有Mg2+、Al3+、H+,其物质的量之比n(Mg2+):n(Al3+):n(H+)为 (填数字,下同);
(4)原溶液中NO3-的浓度为c(NO3-),则c(NO3-)的取值范围为 。
【答案】22.(10分)
(1)Fe3+ (2分) (2)NH4+ + OH-= NH3·H2O(2分) 10/(d-c) mol·L-1(2分)
(3)1:1:1 (2分) (4)c(NO3-)≥0.3 mol·L-1(2分)
【解析】
试题分析:由于原溶液是无色的,所以一定不含黄色Fe3+离子。根据实验①证明可能含有CO32-、SO42-中的一种或两种离子;根据实验②证明0-a发生H++OH-=H2O,a-b发生Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,NH4+ +OH-=NH3H2O,Al(OH)3+OH-=AlO2-+2H2O,据此回答。
(1)根据上述分析,该溶液中一定不存在的阳离子有Fe3+。
(2)在实验②中,NaOH溶液滴至b~c段过程中没有沉淀生成,也没有沉淀溶解,只能是NH4+ 与碱的反应,所以发生的离子反应方程式为NH4+ + OH-= NH3·H2O;当NaOH过量时,发生反应Al(OH)3+ OH-= AlO2-+ 2H2O,根据图像可知,反应的氢氧化铝为0.01mol,则NaOH的物质的量也为0.01mol, NaOH溶液的浓度为0.01mol÷(d-c)×10-3L=10/(d-c) mol·L-1;
(3)根据上述分析可知,氢氧化铝的物质的量为0.01mol,即溶液中的Al3+为0.01mol,氢氧化镁为0.01mol,溶液中的Mg2+为0.01mol,根据化学反应Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,溶液中的Mg2+和Al3+一共消耗0.05molOH-,所以图像中一个单位为0.01mol,则原溶液中含有的Mg2+、Al3+、H+的物质的量之比1:1:1。
(4)根据上述分析,溶液中含有Mg2+,因为MgCO3 是沉淀,则原溶液中没有CO32-,只有SO42-,BaSO4沉淀的物质的量为6.99g÷233g/mol=0.03mol,H+的物质的量为0.01mol,Mg2+的物质的量为0.01mol,Al3+的物质的量为0.01mol,NH4+ 的物质的量为0.03mol,因为溶液呈电中性,若没有其他阳离子,原溶液中的NO3-的物质的量为0.01+0.01×2+0.01×3+0.03-0.03×2=0.03mol,浓度为c(NO3-)=0.03mol÷0.1L=0.3 mol·L-1,若溶液中还有其它阳离子,则c(NO3-)的取值范围为c(NO3-)≥0.3 mol·L-1。