题目内容
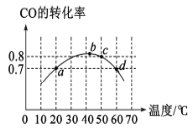
【题目】在2L恒容密闭容器分别投入2molCO和1molO2。进行反应:2CO(g)+O2(g)![]() 2CO2(g)。在相同的时间段(5min)下,测得CO的转化率与温度的关系如图所示。下列说法正确的是
2CO2(g)。在相同的时间段(5min)下,测得CO的转化率与温度的关系如图所示。下列说法正确的是
A.化学平衡常数:K(b)<K(c)<K(d)
B.a点,vO2(正)=0.14mo1·L-1·min-1
C.d点vCO(正)等于a点vCO(正)
D.50℃时,该反应的化学平衡常数K=160L·mol-1
【答案】D
【解析】
根据图示,b点时CO的转化率最大,则b点时反应达到平衡状态,随温度升高,CO的转化率降低,说明反应逆向进行,则正反应为放热反应,据此分析解答。
A.根据分析,2CO(g)+O2(g)![]() 2CO2(g)为放热反应,b、c、d点温度依次升高,温度升高,反应逆向进行,平衡常数减小,则化学平衡常数:K(b)>K(c)>K(d),故A错误;
2CO2(g)为放热反应,b、c、d点温度依次升高,温度升高,反应逆向进行,平衡常数减小,则化学平衡常数:K(b)>K(c)>K(d),故A错误;
B.a点时,CO的转化率为0.7,则CO物质的量的变化量为2mol×0.7=1.4mol,则CO的平均反应速率=![]() =0.14 mo1·L-1·min-1,根据反应速率之比等于化学反应计量系数值比,vO2(正)=
=0.14 mo1·L-1·min-1,根据反应速率之比等于化学反应计量系数值比,vO2(正)=![]() vCO (正)=0.14mo1·L-1·min-1×
vCO (正)=0.14mo1·L-1·min-1×![]() =0.07 mo1·L-1·min-1,即5min内,O2的平均反应速率为0.07 mo1·L-1·min-1,故B错误;
=0.07 mo1·L-1·min-1,即5min内,O2的平均反应速率为0.07 mo1·L-1·min-1,故B错误;
C.a、b两点的温度不同,a点的温度低,b点的温度高,温度越高反应速率越快,则两点vCO(正)不相等,b点vCO(正)大于a点vCO(正),故C错误;
D.50℃时,CO的转化率为0.8,列三段式:

该反应的化学平衡常数K=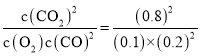 =160L·mol-1,故D正确;
=160L·mol-1,故D正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】酸碱中和滴定是中学化学常见实验。
Ⅰ.下图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL。
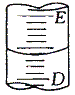
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ.某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A 冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B 量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C 将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D 将物质的量浓度为1.50 mol·L-1的标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E 继续滴定至终点,记下读数为V2。
F 在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G 量取浓硫酸样品5 mL,在烧杯中用蒸馏水溶解。
H 重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为____→ A →_____→_____→D→_____→_____→ H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是________________________;量取20.00mL稀硫酸的仪器是_________。
(3)选用的指示剂是_____________。滴定过程中,视线应注视____________________;判断到达滴定终点的现象是________________;读数时,视线应____________(填“高于”、“低于”或“相平于”)溶液凹液面的最低处。
(4)下表是实验测得的有关数据:
滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
V1 | V2 | ||
① | 20.00 | 0.50 | 22.60 |
② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为____________mol·L-1 (不必写出计算过程)。