题目内容
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: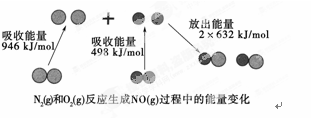
下列说法中正确的是( )
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
A
解析试题分析:反应热是断键吸收的能量和形成化学键所放出的能量的差值,则关键有关数据可知,该反应的反应热=946kJ/mol+498kJ/mol-2×632kJ/mol=-180kJ/mol,所以该反应是放热反应,则选项A正确;1 mol N2(g)和1 mol O2(g)具有的总能量大于2 mol NO(g)具有的总能量,选项B不正确;在放电的条件下,N2(g)和O2(g)混合能直接生成NO,常温下不反应,选项C不正确;NO不是酸性氧化物,D不正确,大阿阿香A。
考点:考查反应热的有关判断和计算、NO的合成与性质
点评:该题是中等难度的试题,贴近贴近高考,基础性强,意在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确反应热与化学键键能以及与物质总能量相对大小的关系,然后结合题意灵活运用即可。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案硫单质有两种常见的同素异形体:单斜硫和正交硫。已知常温常压下:
① S (s,单斜)+O2 (g)→SO2 (g)+297.16kJ;
② S (s,正交)+O2 (g)→SO2 (g)+296.83kJ
下列说法正确的是
| A.常温常压下单斜硫比正交硫稳定 |
B.单斜硫转变为正交硫的能量变化可用下图表示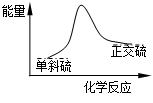 |
| C.S(g)+O2(g)→SO2(g)+Q3 Q3>296.83kJ |
| D.反应①中生成1 L SO2 (g)放出297.16kJ热量 |
关于化学能与热能的叙述,正确的是( )
| A.1mol酸与碱恰好中和时所放出的热量叫中和热 |
| B.化学反应中的能量变化,主要是由化学键的变化引起的 |
| C.燃料电池反应时,化学能降低 |
| D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 |
某化学反应的能量变化如图所示。下列有关叙述正确的是( )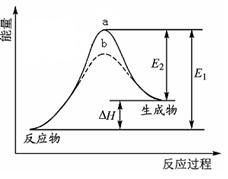
| A.该反应的反应热△H=E2-E1 |
| B.a、b分别对应有催化剂和无催化剂的能量变化 |
| C.催化剂能降低反应的活化能 |
| D.催化剂能改变反应的焓变 |
既是氧化还原反应,又是吸热反应的是
| A.氢气在氧气中燃烧 | B.铝片与稀硫酸反应 |
| C.灼热的炭与水蒸气反应 | D.消石灰与氯化铵固体反应 |
下列说法或表示方法正确的是 ( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
C.300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)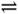 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| D.由C(石墨)=C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 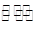 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)