��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ϊ̽��SO2�����ʣ�����ͼ��ʾװ�ý���ʵ�飮��ش��������⣺ 
��1��װ��A��ʢ���������Ƶ����������� �� ���з�����Ӧ�Ļ�ѧ����ʽΪ��
��2��ʵ������У�װ��B��C�з���������ֱ����� �� ��Щ����ֱ�˵��SO2���е�����������װ��B�з�����Ӧ�����ӷ���ʽΪ��
��3��װ��D��Ŀ����̽��SO2��Ʒ�����õĿ����ԣ���д��ʵ�������������
��4��β���ɲ�����Һ���գ�
���𰸡�
��1��������ƿ��Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O
��2����Һ���Ϻ�ɫ��Ϊ��ɫ����ɫ��Һ�г��ֻ�ɫ���ǣ���ԭ�ԣ������ԣ�5SO2+2MnO4��+2H2O=2Mn2++5SO42��+4H+
��3��Ʒ����Һ��ɫ�رշ�Һ©������������ȼ�ƾ��Ƽ��ȣ���Һ�ָ�Ϊ��ɫ
��4��NaOH
���������⣺��1��װ��A��ʢ���������Ƶ�����������������ƿ�����з�����Ӧ�Ļ�ѧ����ʽΪ��Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O�� ���Դ��ǣ�������ƿ��Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O����2�����������ҺΪ�Ϻ�ɫ�����������ԣ�����������л�ԭ�ԣ����߷���������ԭ��Ӧ����۲쵽��ɫ��dzֱ����ȫ��ȥ�������������������Һ�з�����������ԭ��ӦΪ2S2��+SO2+2H2O=3S��+4OH�� �� ��۲쵽���ֻ�ɫ���ǣ�B��SԪ�صĻ��ϼ����ߣ����ֻ�ԭ�ԣ�C�ж�����������Ԫ�صĻ��ϼ۽��ͣ����������ԣ����������Һ�Ͷ����������巢�������ӷ�ӦΪ��2MnO4��+5SO2+2H2O�T2Mn2++5SO42��+4H+ ��
���Դ��ǣ���Һ���Ϻ�ɫ��Ϊ��ɫ�����ֻ�ɫ���ǣ���ԭ�ԣ������ԣ�2MnO4��+5SO2+2H2O�T2Mn2++5SO42��+4H+����3�������������ʹƷ����ɫ����������ɫ�����Һ�ֿɻָ���ɫ�������Ϊ��Ʒ����Һ��ȫ��ɫ�رշ�Һ©������������ȼ�ƾ��Ƽ��ȣ��۲쵽������Ϊ��ɫ��Һ�ָ�Ϊ��ɫ�����Դ��ǣ���Ʒ����Һ��ȫ��ɫ�رշ�Һ©������������ȼ�ƾ��Ƽ��ȣ���ɫ��Һ�ָ�Ϊ��ɫ����4����������������Һ������β�������������ӷ�ӦΪSO2+2OH��=SO32��+H2O�����Դ��ǣ�NaOH��

 ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�����Ŀ�������������һ�ֿɴٽ�����������Ӫ�����ʣ���������ƿ�ͨ�����·�Ӧ�Ƶã�
C6H12O6�������ǣ�+Br2+H2O��C6H12O7���������ᣩ+2HBr
2C6H12O7���������ᣩ+CaCO3��Ca��C6H11O7��2����������ƣ�+H2O+CO2��
������ʵ��ܽ��Լ��±���
�������� | ��������� | �������� | �廯�� | �Ȼ��� |
ˮ�е��ܽ��� | ��������ˮ����������ˮ | ���� | ���� | ���� |
�Ҵ��е��ܽ��� | �� | �� | ���� | ���� |
ʵ���������£�
C6H12O6��Һ ![]()
![]()
![]()
![]() ����Һ
����Һ ![]()
![]()
![]() Ca��C6H11O7��2
Ca��C6H11O7��2
��ش��������⣺
��1���ڢٲ�����ˮ����������ʱ������װ�����ʺϵ��ǣ� �� 
�Ʊ���������ƵĹ����У������ǵ�����Ҳ���������Լ����������������ʺϵ��� ��
A������Cu��OH��2����Һ B������KMnO4��Һ
C��O2/����������ø D��[Ag��NH3��2]OH��Һ
��2���ڢڲ���ַ�Ӧ��CaCO3��������ʣ�࣬��Ŀ��������ʵ���в�����CaCl2���CaCO3 �� ������ ��
��3���ڢ۲�����ȹ��ˣ���ԭ���� ��
��4���ڢܲ������Ҵ��������� ��
��5���ڢ��У�����ϴ�Ӽ�����ʵ��� ��
A.��ˮ
B.��ˮ
C.�Ҵ�
D.�Ҵ���ˮ�����Һ��
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⣮ 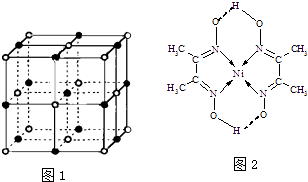
��1����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ����������ʾ��
������/kJmol��1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
Aͨ�����ۣ�BԪ�صĺ�������Ų�ʽΪ ��
��2��ʵ��֤����KCl��MgO��CaO��TiN��4�־���Ľṹ��NaCl����ṹ���ƣ���ͼ1��ʾ������֪3�����Ӿ���ľ��������������
���Ӿ��� | NaCl | KCl | CaO |
������/kJmol��1 | 786 | 715 | 3401 |
���4�����Ӿ��壨������NaCl���۵�Ӹߵ��͵�˳���� �� ����MgO������һ��Mg2+��Χ�������ڽ��ҵȾ����Mg2+������
��3�����������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�ã�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ��� ��
��4��ij�����ķ��ӽṹ��ͼ2��ʾ��������ڲ�����������ţ���
A.���Ӽ�
B.���Լ�
C.������
D.���
E.���
F.�Ǽ��Լ���