题目内容
向8 g某二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知消耗硫酸的体积为100 mL,在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1)根据计算确定金属氧化物的名称。
(2)求通电后硫酸溶液的物质的量浓度(溶液体积按100 mL计算)。
(1)根据计算确定金属氧化物的名称。
(2)求通电后硫酸溶液的物质的量浓度(溶液体积按100 mL计算)。
(1)氧化铜
(2)0.2 mol·L-1
(2)0.2 mol·L-1
设金属氧化物为RO,R的相对原子质量为M,其硫酸盐为RSO4
2RSO4+2H2O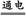 2R + O2↑ + 2H2SO4
2R + O2↑ + 2H2SO4
2M 1 mol 2 mol
1.28 g 0.01 mol x
所以M=64,该金属为铜,氧化物为氧化铜。
电解产生H2SO4的物质的量x="0.02" mol,所以c(H2SO4)="=0.2" mol·L-1。
2RSO4+2H2O
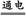 2R + O2↑ + 2H2SO4
2R + O2↑ + 2H2SO42M 1 mol 2 mol
1.28 g 0.01 mol x
所以M=64,该金属为铜,氧化物为氧化铜。
电解产生H2SO4的物质的量x="0.02" mol,所以c(H2SO4)="=0.2" mol·L-1。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目