题目内容
【题目】Cu2O主要用于制造船底防污漆,它是一种鲜红色粉末,几乎不溶于水,在湿空气中逐渐氧化成黑色氧化铜。用含NaOH的Na2SO3溶液还原CuSO4制备Cu2O的工艺流程如下:
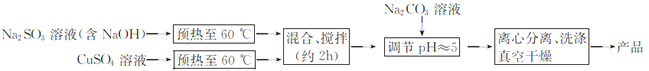
回答下列问题:
(1)流程中涉及的化学反应主要包括:
Ⅰ.Cu2++2OH-=Cu(OH)2↓;Ⅱ.生成CuOH;Ⅲ.2CuOH=Cu2O+H2O。
写出第Ⅱ步反应的离子方程式: ______________________________。
(2)其他反应条件相同时,测得反应时间和溶液的pH对Cu2O产率的影响如下图所示:
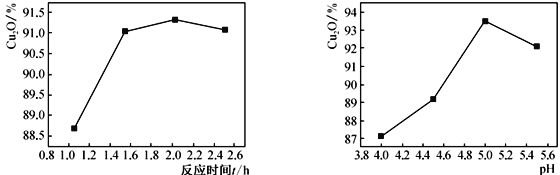
①反应时间超过2h时,Cu2O产率开始降低其原因是____________________________。
②pH<5时,Cu2O产率随pH减小而减小,产品中铜含量增加明显,其原因是______________________(用离子方程式说明)。
(3)为测定产品中Cu2O的含量,称取3.96 g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,至终点时消耗50mL标准液。
①滴定时应选用______(填“酸式”或“碱式”)滴定管,滴定终点的现象是______________________。
②产品与硫酸酸化的Fe2(SO4)3溶液反应的离子方程式为________________________________。
③假定杂质不参与反应,产品中Cu2O的质量分数为_______________。
【答案】 2Cu(OH)2+SO32- ![]() 2CuOH+SO42-+H2O 部分Cu2O被氧化为CuO Cu2O+2H+=Cu+Cu2++H2O 酸式 当最后一滴KMnO4滴入后,溶液呈紫红色且30 S内不褪去 2Fe3++Cu2O+2H+=2Fe2++2Cu2++H2O 91%
2CuOH+SO42-+H2O 部分Cu2O被氧化为CuO Cu2O+2H+=Cu+Cu2++H2O 酸式 当最后一滴KMnO4滴入后,溶液呈紫红色且30 S内不褪去 2Fe3++Cu2O+2H+=2Fe2++2Cu2++H2O 91%
【解析】(1)由题意可知,第Ⅱ步反应是Cu(OH)2被Na2SO3还原为CuOH,离子方程式为2Cu(OH)2+SO32- ![]() 2CuOH+SO42-+H2O。 答案为:2Cu(OH)2+SO32-
2CuOH+SO42-+H2O。 答案为:2Cu(OH)2+SO32- ![]() 2CuOH+SO42-+H2O
2CuOH+SO42-+H2O
(2)①反应时间超过2h时,Cu2O产率开始降低其原因是Cu2O在干燥的空气中虽然稳定,但在湿空气中会慢慢被氧化,生成CuO。
②![]() 时,Cu2O产率随pH减小而减小,说明溶液中的H+也越来越多,发生反应Cu2O+2H+=Cu+Cu2++H2O,导致产品中铜含量增加明显。答案为:部分Cu2O被氧化为CuO 、Cu2O+2H+=Cu+Cu2++H2O
时,Cu2O产率随pH减小而减小,说明溶液中的H+也越来越多,发生反应Cu2O+2H+=Cu+Cu2++H2O,导致产品中铜含量增加明显。答案为:部分Cu2O被氧化为CuO 、Cu2O+2H+=Cu+Cu2++H2O
(3)①高锰酸钾溶液具有强氧化性,只能用酸式滴定管量取;滴定终点的现象是,溶液颜色从无色变成浅红色,且30 S内不褪色。
②产品与硫酸酸化的Fe2(SO4)3溶液反应的离子方程式为:2Fe3++Cu2O+2H+=2Fe2++2Cu2++H2O 。
③假定杂质不参与反应,根据电子守恒有,则![]() ,产品中
,产品中![]() 的质量分数为
的质量分数为![]() 。答案为:当最后一滴KMnO4滴入后,溶液呈紫红色且30 S内不褪去 、2Fe3++Cu2O+2H+=2Fe2++2Cu2++H2O 、91%
。答案为:当最后一滴KMnO4滴入后,溶液呈紫红色且30 S内不褪去 、2Fe3++Cu2O+2H+=2Fe2++2Cu2++H2O 、91%

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案