题目内容
【题目】Ⅰ.甲烷—空气燃料电池若以KOH溶液为电解质溶液,负极的电极反应式为______________;若以稀硫酸为电解质溶液,正极的电极反应式为 __________________________。
Ⅱ.现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:__________________,正极:___________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)________。

该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的数目是_________。
【答案】 CH4+10OH--8e-=CO32-+7H2O O2+4e-+4H+=2H2O Cu -2e-= Cu2+ 2Fe3++2e-=2Fe2+ 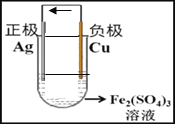 0.1NA
0.1NA
【解析】试题分析:Ⅰ. 碱性甲烷燃料电池,总反应为![]() ,甲烷失电子发生氧化反应,为电池负极;若以稀硫酸为电解质溶液,总反应是
,甲烷失电子发生氧化反应,为电池负极;若以稀硫酸为电解质溶液,总反应是![]() ,氧气在电极正极得电子发生还原反应。
,氧气在电极正极得电子发生还原反应。
Ⅱ.氧化性Cu2+<Fe3+,要证明Cu2+<Fe3+,根据氧化剂氧化性大于氧化产物,需要发生![]() ;
;
该装置反应一段时间后,溶液的质量增加3.2 g,说明有3.2g铜参加反应。
解析:Ⅰ. 甲烷—空气燃料电池若以KOH溶液为电解质溶液,总反应为![]() ,甲烷失电子发生氧化反应,为电池负极,负极的电极反应为CH4+10OH--8e-=CO32-+7H2O;若以稀硫酸为电解质溶液,总反应是
,甲烷失电子发生氧化反应,为电池负极,负极的电极反应为CH4+10OH--8e-=CO32-+7H2O;若以稀硫酸为电解质溶液,总反应是![]() ;若以稀硫酸为电解质溶液,正极是氧气得电子发生还原反应,电极反应式为 O2+4e-+4H+=2H2O。
;若以稀硫酸为电解质溶液,正极是氧气得电子发生还原反应,电极反应式为 O2+4e-+4H+=2H2O。
Ⅱ.氧化性Cu2+<Fe3+,要证明Cu2+<Fe3+,根据氧化剂氧化性大于氧化产物,需要发生![]() ,选择纯银片、纯铜片, Fe2(SO4)3溶液、大烧杯、导线若干组成原电池。(1)铜是负极电极反应式,Cu -2e-= Cu2+,正极是铁离子得电子生成亚铁离子:2Fe3++2e-=2Fe2+。
,选择纯银片、纯铜片, Fe2(SO4)3溶液、大烧杯、导线若干组成原电池。(1)铜是负极电极反应式,Cu -2e-= Cu2+,正极是铁离子得电子生成亚铁离子:2Fe3++2e-=2Fe2+。
(2) 。
。
溶液的质量增加3.2 g,说明有3.2g铜参加反应,转移电子的物质的量xmol
根据

![]()
X=0.1mol,转移电子的数目是0.1NA

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
