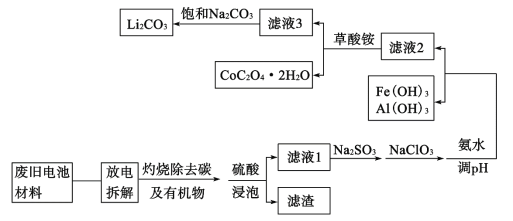
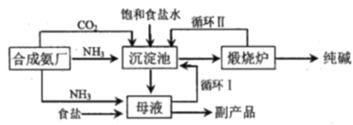
题目内容
【题目】将 Na2CO3 和 Na2S 按 1∶2 的物质的量之比配成溶液,再通入 SO2,可制取 Na2S2O3,同时放出CO2。在该反应中( )
A.被氧化与被还原的原子个数比为 2∶1
B.相同条件下,每吸收 1 m3 SO2 就会放出 2.5 m3 CO2
C.每 1 mol Na2S 反应,则生成的 Na2S2O3 为 1.5 mol
D.若有 106 g Na2CO3 发生反应,反应中转移的电子的物质的量为 4 mol
【答案】C
【解析】
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在Na2S 中S元素的化合价从-2价升高到+2价,SO2中S的化合价从+4价降低到+2价,据此分析。
A. 由反应方程式中S元素的化合价变化可知,硫元素既被氧化又被还原,被氧化与被还原的原子个数比为1∶2,故A错误;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中SO2与CO2的物质的量之比为4∶1,相同条件下的气体的物质的量之比等于气体的体积之比,每吸收 4m3 SO2 就会放出1 m3 CO2,故B错误;
C. 反应中Na2S和Na2S2O3的物质的量之比为2∶3,每 1 mol Na2S 反应,则生成的 Na2S2O3 为 1.5 mol,故C正确;
D. 反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在Na2S 中S元素的化合价从-2价升高到+2价,SO2中S的化合价从+4价降低到+2价,若有 106 g Na2CO3 发生反应,则碳酸钠的物质的量=![]() =
=![]() =1mol,根据方程式1mol Na2CO3反应时转移8mol电子,故D错误;
=1mol,根据方程式1mol Na2CO3反应时转移8mol电子,故D错误;
答案选C。