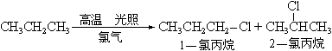题目内容
【题目】【化学——选修3:物质结构与性质】
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做
一种含氧酸盐)。A晶体的晶胞为正方体(如右图)。

①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的 。
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如右图),若晶胞棱长为540.0 pm,则晶胞密度为 g·cm—3(列式并计算)。

【答案】(1)sp3杂化,
(2)2
(3)①TiO2+BaCO3= BaTiO3+CO2↑②6 ③面心
(4)3d9高
(5)
【解析】试题分析:根据题给信息推断X为氢元素,Y为氮元素,Z为钛元素,R为铜元素,Q为锌元素。
(1)NH3分子中含有3个键,氮原子有1对孤对电子,中心原子的杂化轨道类型是sp3,离子化合物NH5的电子式是 。
。
(2)N2的结构式为N≡N,两个成键原子间有且只有1个键,CO与N2属于等电子体,故1 个CO分子中含有的π键数目是2个。
(3)①根据A的晶胞结构利用切割法计算,1个晶胞中含钡数目为1,含钛数目为8×1/8=1,含氧数目为12×1/4=3,A的化学式为BaTiO3。TiO2和碳酸钡在熔融状态下反应生成BaTiO3和二氧化碳,化学方程式为TiO2+BaCO3= BaTiO3+CO2↑;②在A晶体中,Ti的配位数为6(上、下、前、后、左、右均与O直接相连);③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的面心。
(4)R为铜元素,原子序数为29,根据构造原理判断Cu2+离子的外围电子层电子排布式为3d9。Cu2O和Cu2S为结构相似的离子晶体,离子所带的电荷相同,氧离子半径小于硫离子半径,氧化亚铜的晶格能大于硫化亚铜的晶格能,故Cu2O的熔点比Cu2S的高。
(5)ZnS晶胞中含硫原子数目为8×1/8+6×1/2=4,含锌原子数目为4,则1mol晶胞的质量为4×(65+32)g,晶胞为正方体,若晶胞棱长为540.0 pm,则晶胞密度为![]() g·cm—3。
g·cm—3。