题目内容
向新制备的氯水中不断滴入饱和NaCl溶液,则下列曲线符合氯水pH变化的是( )
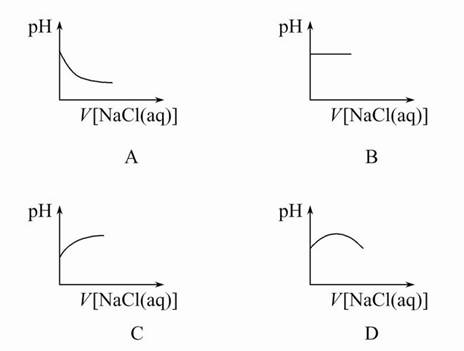

C
新制氯水中存在的主要平衡是Cl2+H2O H++Cl-+HClO,当加入饱和NaCl溶液时,c(Cl-)增大,使平衡逆向移动,c(H+)减小。
H++Cl-+HClO,当加入饱和NaCl溶液时,c(Cl-)增大,使平衡逆向移动,c(H+)减小。
 H++Cl-+HClO,当加入饱和NaCl溶液时,c(Cl-)增大,使平衡逆向移动,c(H+)减小。
H++Cl-+HClO,当加入饱和NaCl溶液时,c(Cl-)增大,使平衡逆向移动,c(H+)减小。
练习册系列答案
相关题目
题目内容

 H++Cl-+HClO,当加入饱和NaCl溶液时,c(Cl-)增大,使平衡逆向移动,c(H+)减小。
H++Cl-+HClO,当加入饱和NaCl溶液时,c(Cl-)增大,使平衡逆向移动,c(H+)减小。