��Ŀ����
����Ŀ����2L�ܱ������У�800��ʱ��Ӧ2NO��g����O2��g��![]() 2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����

��1��������Ӧ________����ǡ����ǡ������淴Ӧ��
��2����ͼ��ʾ����ʾNO2�仯���ߵ��� ________����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��________��
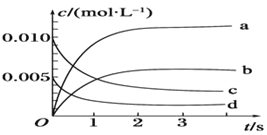
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����_______������ţ���
a��v��NO2����2v��O2�� b��������ѹǿ���ֲ���
c��v����NO����2v����O2�� d���������ܶȱ��ֲ���
���𰸡���1����
��2��b��v��1.5��10��3mol����L��s����1
��3��bc
��������
�����������1�����ݱ������ݿ�֪��3sʱNOΪ0.007mol���Ҳ�������ʱ������ƶ���С�����Է�Ӧ������ȫ���У����Ը÷�Ӧ�ǿ��淴Ӧ��
�ʴ�Ϊ���ǣ�
��2��NO2�Dz���淴Ӧ����Ũ�������ɷ���ʽ��֪ƽ��ʱ��c��NO2��=��c��NO��= ![]() =0.0065mol/L������ͼ�б�ʾNO2�仯��������b��2s����NO��ʾ��ƽ����Ӧ����v��NO��=
=0.0065mol/L������ͼ�б�ʾNO2�仯��������b��2s����NO��ʾ��ƽ����Ӧ����v��NO��= =3.0��10-3molL-1s-1������֮�ȵ��ڻ�ѧ������֮�ȣ�����v��O2��=
=3.0��10-3molL-1s-1������֮�ȵ��ڻ�ѧ������֮�ȣ�����v��O2��=![]() v��NO��=
v��NO��=![]() ��3.0��10-3molL-1s-1=1.5��10-3molL-1s-1��
��3.0��10-3molL-1s-1=1.5��10-3molL-1s-1��
�ʴ�Ϊ��b��1.5��10-3molL-1s-1��
��3��a������Ӧ�ﵽƽ�⣬��v(NO2)��=2v(O2)�����������ʵ�������δָ������˲����жϷ�Ӧ�Ƿ�ﵽƽ�⣬��a����b�����ڸ÷�Ӧ�Ƿ�Ӧǰ������������ȵķ�Ӧ��������������ѹǿ���ֲ��䣬��Ӧ�ﵽƽ�⣬��b��ȷ��c��v��(NO)=2v��(O2)����NO��O2��Ũ�Ȳ��䣬��Ӧ�ﵽƽ�⣬��c��ȷ��d����������������䣬�����ݻ����䣬�����������ܶ�ʼ�����ֲ��䣬��˲����жϷ�Ӧ�Ƿ�ﵽƽ�⣬��d����
������bc��

 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
�ش���������
��1��ZԪ�������ڱ��е�λ��Ϊ__________��
��2������Ԫ��ԭ�Ӱ뾶��������лԪ�ط�����__________��
��3��������ʵ��˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ����__________��
a��Y������H2S��Һ��Ӧ����Һ�����
b����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ�
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��4��X��Z��Ԫ�صĵ��ʷ�Ӧ����1molX����ۻ�����ָ������£�����687kJ����֪�û�������ۡ��е�ֱ�Ϊ-69����58����д���÷�Ӧ���Ȼ�ѧ����ʽ__________��
��5��̼��þ�γɵ�1mol������Q��ˮ��Ӧ������2molMg��OH��2��1mol��������������̼��������Ϊ9:1�����ĵ���ʽΪ__________��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪ__________��
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���ɵ�����������ɱ�������������ɣ��������Է���������С��50��Ϊ��ֹ��Ⱦ����������������ȫת��Ϊ��ۺ������Σ�����1L2.2mol/LNaOH��Һ��1molO2������������ķ���ʽ�����ʵ����ֱ�Ϊ__________����������ͭ���ʵ���Ϊ__________��


