题目内容
8.对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )| A. | 0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)═c(A-)+c(Cl-) | |
| D. | 在25℃100 mL NH4Cl溶液中:c(Cl-)═c(NH4+)+c(NH3•H2O) |
分析 A.(NH4)2SO4溶液中,NH4+水解程度一般较小,c(NH4+)>c(SO42-);
B.从物料守恒的角度分析;
C.根据混合液中的电荷守恒进行分析;
D.根据氯化铵溶液中的物料守恒进行判断.
解答 解:A.(NH4)2SO4溶液中,NH4+水解程度一般较小,c(NH4+)>c(SO42-),溶液呈酸性c(H+)>c(OH-),应为c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B.从物料守恒的角度分析,NaHCO3溶液中存在c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.溶液呈电中性,应存在,c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故C错误;
D.从物料守恒的角度分析,溶液中存在c(Cl-)=c(NH4+)+c(NH3•H2O),故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,明确盐的水解原理及电荷守恒、物料守恒的应用方法为解答关键,试题侧重考察学生的分析能力及灵活运用基础知识的能力.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
18.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
| A. | NaCl NaBr | B. | NaCl Na2SO4 | ||
| C. | NaCl Na2SO4 I2 | D. | NaCl NaI Na2SO4 |
19.既属于氧化还原反应又属于分解反应的是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Zn+H2SO4═ZnSO4+H2↑ | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2H2O═H2↑+O2↑ |
13.对于A2+3B2═2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的为( )
| A. | V(B2)=0.8mol/( L•s) | B. | V(A2)=0.8mol/( L•min) | ||
| C. | V(C)=0.6mol/( L•s) | D. | V(D)=0.8mol/( L•s) |
20.胃酸过多会导致消化不良和胃痛,可以服用抗酸药来缓解胃部不适,下列各组成物质都属于抗酸药的是( )
| A. | NaHCO3、NaOH、Mg(OH)2 | B. | NaHCO3、Na2CO3、MgCO3 | ||
| C. | NaHCO3、MgCO3、Al(OH)3 | D. | Na2CO3、MgCO3、CaO |
17.某同学为了检验纤维素的水解产物是否为葡萄糖,他将纤维素与70%的硫酸共热后加入新制Cu(OH)2悬浊液并加热煮沸,无红色沉淀生成,以下解释正确的是( )
| A. | 纤维素水解产物中无葡萄糖 | |
| B. | 使用的硫酸过浓,只发生了脱水反应 | |
| C. | 由于水解后混合液中含有H2SO4,所以见不到红色沉淀 | |
| D. | 加热时间不够长,所以见不到红色沉淀 |
18.下列物质属于电解质的是
①碱石灰 ②熔融Na2O ③NaCl溶液 ④NaOH ⑤液态氧 ⑥KClO3⑦盐酸( )
①碱石灰 ②熔融Na2O ③NaCl溶液 ④NaOH ⑤液态氧 ⑥KClO3⑦盐酸( )
| A. | ①②④⑥⑦ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ①②④⑤⑥ |
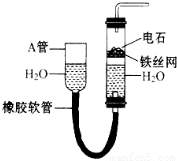 如图装置可以制取乙炔,请填空:
如图装置可以制取乙炔,请填空: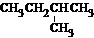
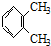 和
和