题目内容
A、B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C2+的电子排布式和Ar相同;D的原子序数为24.
(1)判断元素:A
(2)以上这四种元素中,属于d区的是
(3)C在周期表中的位置为
(4)写出CB2的电子式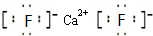
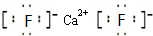 .
.
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有
②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是
(1)判断元素:A
H
H
、BF
F
、CCa
Ca
、DCr
Cr
.(2)以上这四种元素中,属于d区的是
Cr
Cr
(填元素符号).(3)C在周期表中的位置为
四
四
周期ⅡA
ⅡA
族.(4)写出CB2的电子式
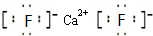
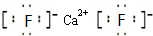
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有
K、Cu
K、Cu
(填元素符号②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是
非极性
非极性
(填“极性”或“非极性”)分子.分析:A、B、C、D为四种元素,A原子的1S轨道为半充满,则A为氢元素;在元素周期表中,B的电负性最大,则B为氟元素;C2+的电子排布式和Ar相同,C2+的核外电子数为18,故其质子数为18+2=20,为Ca元素;D的原子序数为24,则D为Cr元素,据此解答.
解答:解:A、B、C、D为四种元素,A原子的1S轨道为半充满,则A为氢元素;在元素周期表中,B的电负性最大,则B为氟元素;C2+的电子排布式和Ar相同,C2+的核外电子数为18,故其质子数为18+2=20,为Ca元素;D的原子序数为24,则D为Cr元素,
(1)由上述分析可知,A为H、B为F、C为Ca、D为Cr,
故答案为:H;F;Ca;Cr;
(2)以上四种元素中,H、Ca处于s区,F处于p区,属于d区的是Cr,
故答案为:Cr;
(3)C为Ca元素,在周期表中的位置为四周期ⅡA族,
故答案为:四;ⅡA;
(4)CB2是CaF2,属于离子化合物,由钙离子与氟离子构成,其电子式为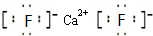 ,
,
故答案为: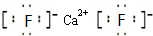 ;
;
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.
①D为Cr元素,最外层电子排布为4s1,与Cr同周期的所有元素的基态原子中最外层电子数与Cr原子相同的元素还有K、Cu,
故答案为:K、Cu;
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,根据相似相容原理,可判断DO2Cl2是非极性分子,
故答案为:非极性.
(1)由上述分析可知,A为H、B为F、C为Ca、D为Cr,
故答案为:H;F;Ca;Cr;
(2)以上四种元素中,H、Ca处于s区,F处于p区,属于d区的是Cr,
故答案为:Cr;
(3)C为Ca元素,在周期表中的位置为四周期ⅡA族,
故答案为:四;ⅡA;
(4)CB2是CaF2,属于离子化合物,由钙离子与氟离子构成,其电子式为
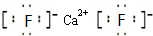 ,
,故答案为:
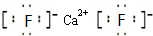 ;
;(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.
①D为Cr元素,最外层电子排布为4s1,与Cr同周期的所有元素的基态原子中最外层电子数与Cr原子相同的元素还有K、Cu,
故答案为:K、Cu;
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,根据相似相容原理,可判断DO2Cl2是非极性分子,
故答案为:非极性.
点评:本题考查结构性质位置关系、常用化学用语、核外电子排布规律、分子性质、难度不大,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目

