题目内容
A、B、C、D为四种短周期元素,原子序数依次增大.A原子最外层有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D原子L层上的电子数等于K、M两个电子层上的电子数之和.请回答:
(1)A元素的最高价氧化物的水化物的化学式是 ;
(2)物质E中所包含的化学键有 ;
(3)写出C、D两元素形成的化合物的电子式 ;
(4)把盛有48mL AB、AB2混合气体的容器倒置于水中(同温同压下),待液面稳定后,容器内气体体积变为24mL,则原混合气体中AB的体积分数为 .
(1)A元素的最高价氧化物的水化物的化学式是
(2)物质E中所包含的化学键有
(3)写出C、D两元素形成的化合物的电子式
(4)把盛有48mL AB、AB2混合气体的容器倒置于水中(同温同压下),待液面稳定后,容器内气体体积变为24mL,则原混合气体中AB的体积分数为
分析:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有5个电子,则A为N元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外电子排布为2、8、6,则D为S元素,据此解答.
解答:解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有5个电子,则A为N元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外电子排布为2、8、6,则D为S元素,
(1)A为N元素,其最高价氧化物的水化物的化学式是HNO3,
故答案为:HNO3;
(2)物质E为Na2O2,所包含的化学键有:离子键和非极性共价键,
故答案为:离子键和非极性共价键;
(3)C、D两元素形成的化合物为Na2S,由钠离子与硫离子构成,其电子式为: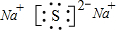 ,
,
故答案为: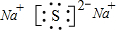 ;
;
(4)把盛有48mL NO、NO2混合气体的容器倒置于水中(同温同压下),待液面稳定后,容器内气体体积变为24mL,令NO2的体积为x mL,则:
3NO2+H2O=2HNO3+NO 体积减小
3 1 2
x mL 48mL-24mL=24mL,
故3:2=x mL:24mL,解得x=36,
故NO的体积为48mL-36mL=12mL,其体积分数为
×100%=25%,
故答案为:25%.
(1)A为N元素,其最高价氧化物的水化物的化学式是HNO3,
故答案为:HNO3;
(2)物质E为Na2O2,所包含的化学键有:离子键和非极性共价键,
故答案为:离子键和非极性共价键;
(3)C、D两元素形成的化合物为Na2S,由钠离子与硫离子构成,其电子式为:
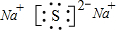 ,
,故答案为:
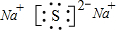 ;
;(4)把盛有48mL NO、NO2混合气体的容器倒置于水中(同温同压下),待液面稳定后,容器内气体体积变为24mL,令NO2的体积为x mL,则:
3NO2+H2O=2HNO3+NO 体积减小
3 1 2
x mL 48mL-24mL=24mL,
故3:2=x mL:24mL,解得x=36,
故NO的体积为48mL-36mL=12mL,其体积分数为
| 12mL |
| 48mL |
故答案为:25%.
点评:本题考查元素推断、常用化学用语、化学键、化学计算等,难度中等,推断元素是解题关键,(4)中注意利用差量法可以简化计算.

练习册系列答案
相关题目

