题目内容
【题目】LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850°C时,LiNiO2会分解。请按要求回答下列问题:
(1)LiNiO2中Ni的化合价为___________,工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800°C制得 LiNiO2,该反应的化学方程式为___________,加热温度不宜过高的原因是_________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是_______。
(2)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺如下:

已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①滤渣Ⅱ为___________。
②“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii.______________________(用离子方程式表示)。
③转化操作后,还需经过过滤、洗涤、烘干得到产品。检验Ni(OH)2是否洗涤干净的实验操作是___________。
④调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?___________(列式计算,并使用必要的文字说明)。
【答案】+3 4Ni(OH)2+4LiOH+O2![]() 4LiNiO2+6H2O 防止温度高于850℃时LiNiO2分解 产生氮氧化物,污染环境 Al(OH)3、Fe(OH)3 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ 取最后一次洗涤液,先加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀产生,则洗涤干净 pH=5,滤液中c(OH-)=10-9mol/L,Qc=c2(OH-)·c(Ni2+)=2×10-18<Ksp[Ni(OH)2]=1.6×10-14,故无Ni(OH)2沉淀产生。
4LiNiO2+6H2O 防止温度高于850℃时LiNiO2分解 产生氮氧化物,污染环境 Al(OH)3、Fe(OH)3 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ 取最后一次洗涤液,先加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀产生,则洗涤干净 pH=5,滤液中c(OH-)=10-9mol/L,Qc=c2(OH-)·c(Ni2+)=2×10-18<Ksp[Ni(OH)2]=1.6×10-14,故无Ni(OH)2沉淀产生。
【解析】
(1)根据化合物中元素正负化合价代数和等于0判断Ni的化合价;根据反应物、生成物结合电子守恒、原子守恒,书写反应方程式;从温度过高,物质的稳定性分析,结合LiNO3高温分解产生氮氧化合物的毒性判断;
(2)废旧二次电池用硫酸溶解得到的溶液中含有Ni2+、Al3+、Fe3+、Mn2+,然后向溶液中加入NiO,调整溶液的pH=5,由于Fe(OH)3、Al(OH)3的溶度积常数小,这时溶液中含有Al3+、Fe3+形成Al(OH)3、Fe(OH)3沉淀进入滤渣II中,然后载向滤液中加入(NH4)2S2O8氧化溶液中Mn2+变为MnO2进入滤渣III中,再向溶液中加入NaOH溶液,Ni2+形成Ni(OH)2沉淀。据此分析解答。
(1)由于化合物中所有元素正负化合价的代数和等于0,Li为+1价,O为-2价,所以LiNiO2中Ni的化合价为+3价;在工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800°C制得 LiNiO2,该反应的化学方程式为4Ni(OH)2+4LiOH+O2![]() 4LiNiO2+6H2O,加热温度不宜过高,是因为温度高于850℃时LiNiO2会发生分解反应,工业上也可用LiNO3代替上述工艺中的LiOH,但也存在一定缺点,原因是LiNO3受热分解会产生氮氧化物,导致污染环境;
4LiNiO2+6H2O,加热温度不宜过高,是因为温度高于850℃时LiNiO2会发生分解反应,工业上也可用LiNO3代替上述工艺中的LiOH,但也存在一定缺点,原因是LiNO3受热分解会产生氮氧化物,导致污染环境;
(2)①根据上述分析可知滤渣II中含有的成分是Al(OH)3、Fe(OH)3;
②“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
第一步反应是5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;反应产生的MnO4-再将溶液中的Mn2+氧化,最终都变为MnO2,所以第二步反应用离子方程式表示为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
③Ni(OH)2沉淀是从含Na+、SO42-等的溶液中过滤出来的,因此检验Ni(OH)2是否洗涤干净可通过检验洗涤液中是否含有SO42-检验,实验操作是取最后一次洗涤液,先加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀产生,则洗涤干净;
④调pH=5操作时,c(OH-)=![]() =
=![]() =10-9mol/L,已知溶液中Ni2+浓度为2.0mol/L,则c(Ni2+) c2(OH-) =2.0 ×(10-9)2=2.0 ×10-18< Ksp[Ni(OH)2]=1.6×10-14,所以 “滤渣II”中不存在Ni(OH)2沉淀。
=10-9mol/L,已知溶液中Ni2+浓度为2.0mol/L,则c(Ni2+) c2(OH-) =2.0 ×(10-9)2=2.0 ×10-18< Ksp[Ni(OH)2]=1.6×10-14,所以 “滤渣II”中不存在Ni(OH)2沉淀。

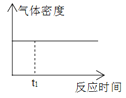
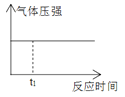
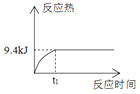
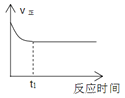
【题目】1mol H2和1mol I2置于恒温恒容密闭容器中发生反应:H2(g)+I2(g)![]() 2HI(g)+9.4kJ,至t1时刻到达平衡状态,下列物理量与反应时间的关系不符合事实的是( )
2HI(g)+9.4kJ,至t1时刻到达平衡状态,下列物理量与反应时间的关系不符合事实的是( )
|
|
|
|
A | B | C | D |
A. AB. BC. CD. D
【题目】已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略体积变化。
A. 实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B. 实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C. 实验③中,存在可逆反应: Fe3+ + 4Cl-+ 2H2O ![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D. 实验④,可证明升高温度,Fe3+水解平衡正向移动