题目内容
下列叙述中,不正确的是( )
①共价化合物中全部为共价键,离子键是阳离子与阴离子之间的相互吸引
②单质分子中可能含有共价键
③H2O2、NH3、HCN分子中都存在三对共用电子对
④CO2和PCl3化学键类型完全相同,且所有原子最外层都达到8电子稳定结构
⑤干冰升华、HCl气体溶于水化学键都没有被破坏
⑥HF的沸点比HCl的沸点高,是由于F的非金属性比Cl强.
①共价化合物中全部为共价键,离子键是阳离子与阴离子之间的相互吸引
②单质分子中可能含有共价键
③H2O2、NH3、HCN分子中都存在三对共用电子对
④CO2和PCl3化学键类型完全相同,且所有原子最外层都达到8电子稳定结构
⑤干冰升华、HCl气体溶于水化学键都没有被破坏
⑥HF的沸点比HCl的沸点高,是由于F的非金属性比Cl强.
| A、①②③⑥ | B、①②④⑤ |
| C、①③⑤⑥ | D、③④⑤⑥ |
考点:化学键
专题:化学键与晶体结构
分析:①共价化合物中全部为共价键,离子键是阳离子与阴离子之间的相互作用;
②单质分子中可能含有共价键,也可能不含化学键;
③HCN分子中存在四对共用电子对;
④在ABn型分子中,如果A原子的族序数+成键数=8,则该分子中所有原子最外层都达到8电子稳定结构;
⑤HCl气体溶于水化学键被破坏;
⑥氢键影响氢化物的熔沸点.
②单质分子中可能含有共价键,也可能不含化学键;
③HCN分子中存在四对共用电子对;
④在ABn型分子中,如果A原子的族序数+成键数=8,则该分子中所有原子最外层都达到8电子稳定结构;
⑤HCl气体溶于水化学键被破坏;
⑥氢键影响氢化物的熔沸点.
解答:
解:①离子键是阳离子与阴离子之间的相互作用,包含吸引力和排斥力,故错误;
②单质分子中可能含有共价键,也可能不含化学键,如稀有气体中不含化学键,故正确;
③HCN分子结构式为H-C≡N,所以该分子中存在四对共用电子对,故错误;
④在ABn型分子中,如果A原子的族序数+成键数=8,则该分子中所有原子最外层都达到8电子稳定结构,
CO2和PCl3化学键都是极性共价键,所以化学键类型完全相同,二氧化碳的结构式为O=C=O,所有原子都达到8电子结构;PCl3分子中P原子族序数+成键数=5+3=8,所以该分子中所有原子最外层都达到8电子稳定结构,故正确;
⑤干冰升华只发生物理变化,破坏分子间作用力而不破坏化学键,HCl气体溶于水,在水分子的作用下电离出阴阳离子,所以化学键被破坏,故错误;
⑥HF的沸点比HCl的沸点高,是由于HF中含有氢键、HCl中不含氢键,氢键影响氢化物的沸点,故错误;
故选C.
②单质分子中可能含有共价键,也可能不含化学键,如稀有气体中不含化学键,故正确;
③HCN分子结构式为H-C≡N,所以该分子中存在四对共用电子对,故错误;
④在ABn型分子中,如果A原子的族序数+成键数=8,则该分子中所有原子最外层都达到8电子稳定结构,
CO2和PCl3化学键都是极性共价键,所以化学键类型完全相同,二氧化碳的结构式为O=C=O,所有原子都达到8电子结构;PCl3分子中P原子族序数+成键数=5+3=8,所以该分子中所有原子最外层都达到8电子稳定结构,故正确;
⑤干冰升华只发生物理变化,破坏分子间作用力而不破坏化学键,HCl气体溶于水,在水分子的作用下电离出阴阳离子,所以化学键被破坏,故错误;
⑥HF的沸点比HCl的沸点高,是由于HF中含有氢键、HCl中不含氢键,氢键影响氢化物的沸点,故错误;
故选C.
点评:本题考查较综合,涉及氢键、8电子稳定结构、化学键等知识点,明确物质的结构、物质的性质是解本题关键,知道8电子结构的判断方法,再结合基本概念分析解答,题目难度不大.

练习册系列答案
相关题目
常温下H2S饱和溶液1L,其浓度为0.1mol/L,电离方程式为H2S?H++HS-,HS-?H++S2-若要使溶液中的pH值减小,同时使c(S2-)减小,可采取的措施是( )
| A、加入适量水 |
| B、加入适量NaOH固体 |
| C、通入适量的Cl2 |
| D、加入适量的CuSO4 |
X、Y、Z、W有如图所示的转化关系, ,则X、W可能是( )
,则X、W可能是( )
①C、O2 ②Fe、HNO3 ③S、O2.
 ,则X、W可能是( )
,则X、W可能是( )①C、O2 ②Fe、HNO3 ③S、O2.
| A、①② | B、①③ | C、②③ | D、①②③ |
下列物质不属于化石燃料的是( )
| A、木材 | B、煤 | C、石油 | D、天然气 |
下列离子方程式正确的是( )
| A、向水中通入氯气:Cl2+H2O═2H++Cl-+ClO- |
| B、碳酸钠溶液中通入二氧化碳:CO32-+CO2+H2O═2HCO3- |
| C、实验室制备氯气:MnO2+4HCl(浓)═2Mn2++2H2O+2Cl2↑ |
| D、稀硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
下列叙述中,正确的是( )
| A、用惰性电极电解MgCl2溶液分别得到单质Mg和Cl2 |
| B、常温下,某溶液中由水电离出的c(OH-)=1×10-10mol/L,该溶液一定呈酸性 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D、在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )
| A、原子还原性:Z>Y>X |
| B、离子半径:Yb->Z(b+1)->Xa+ |
| C、它们的原子序数:X>Y>Z |
| D、气态氢化物的稳定性Hb+1Z一定大于HbY |
下列措施是为了降低化学反应速率的是( )
| A、食品放在冰箱中贮藏 |
| B、双氧水制氧气时加入少量二氧化锰 |
| C、试管中进行镁和水反应时,稍微加热 |
| D、铁粉代替铁钉与稀硫酸反应制取氢气 |
下列说法正确的是( )
A、 的名称是2,3-二甲基己烷 的名称是2,3-二甲基己烷 |
B、阿司匹林的键线式是 |
C、反应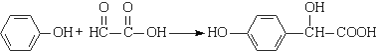 属于加成反应,理论上该反的原子利用率为100% 属于加成反应,理论上该反的原子利用率为100% |
D、有机物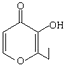 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 |