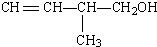题目内容
常温下H2S饱和溶液1L,其浓度为0.1mol/L,电离方程式为H2S?H++HS-,HS-?H++S2-若要使溶液中的pH值减小,同时使c(S2-)减小,可采取的措施是( )
| A、加入适量水 |
| B、加入适量NaOH固体 |
| C、通入适量的Cl2 |
| D、加入适量的CuSO4 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:H2S的电离方程式为:H2S?H++HS-、HS-=S2-+H+,若要使溶液的pH和c(S2-)减小,应该使平衡向正反应方向移动,生成的硫离子和其它离子反应生成气体或沉淀,溶液中氢离子浓度增大,以此解答该题.
解答:
解:A.加入适量水能促进水的电离,但导致溶液中氢离子浓度和硫离子浓度都减小,溶液的pH值增大,故A错误;
B.氢硫酸和氢氧化钠反应生成硫化钠和水,反应方程式为:H2S+2NaOH=Na2S+H2O,所以加入氢氧化钠后促进氢硫酸的电离,使硫离子浓度增大,氢离子浓度减小,故B错误;
C.通入适量的Cl2,发生反应H2S+Cl2=2HCl+S,溶液中的pH值减小,同时c(S2-)减小,故C正确;
D.氢硫酸和硫酸铜的反应方程式为:H2S+CuSO4=CuS↓+H2SO4,弱酸变成强酸溶液,溶液的PH值减小,硫离子和铜离子生成硫化铜沉淀导致硫离子浓度降低,故D正确.
故选CD.
B.氢硫酸和氢氧化钠反应生成硫化钠和水,反应方程式为:H2S+2NaOH=Na2S+H2O,所以加入氢氧化钠后促进氢硫酸的电离,使硫离子浓度增大,氢离子浓度减小,故B错误;
C.通入适量的Cl2,发生反应H2S+Cl2=2HCl+S,溶液中的pH值减小,同时c(S2-)减小,故C正确;
D.氢硫酸和硫酸铜的反应方程式为:H2S+CuSO4=CuS↓+H2SO4,弱酸变成强酸溶液,溶液的PH值减小,硫离子和铜离子生成硫化铜沉淀导致硫离子浓度降低,故D正确.
故选CD.
点评:本题考查了弱电解质的电离,明确物质间的反应是解本题关键,根据溶液中参加反应的离子来确定离子浓度变化,题目难度不大.

练习册系列答案
相关题目
下列各组物质不能实现直接转化的是( )
| A、S→SO2→H2SO4→MgSO4 |
| B、Cu→CuCl2→Cu(NO3)2→Cu(OH)2 |
| C、Al→Al2O3→Al(OH)3→NaAlO2 |
| D、Na→Na2O→Na2CO3→NaCl |
 可逆反应mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是( )
可逆反应mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是( )| A、温度降低,化学平衡向正反应方向移动 |
| B、使用催化剂,D的物质的量分数增加 |
| C、化学方程式系数m+n=r+q |
| D、物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动 |
下列说法错误的是( )
| A、浓硫酸可用于干燥O2、CO2 |
| B、稀硝酸和铁反应可产生氢气 |
| C、不可将水直接倒入浓硫酸里进行稀释 |
| D、金属钠着火时不可用水来熄灭 |