题目内容
2.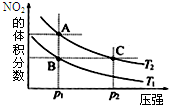 已知反应N2O4(g)?2NO2(g)△H=+57kJ/mol,在温度为T1、T2时,平衡
已知反应N2O4(g)?2NO2(g)△H=+57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
| A. | A、C两点气体的平均相对分子质量:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | 由状态B到状态A,可以用加热的方法 | |
| D. | A、C两点的反应速率:A>C |
分析 该反应是一个反应前后气体计量数增大的吸热反应,升高温度平衡正向移动,二氧化氮含量增大;增大压强,平衡逆向移动,二氧化氮含量减小,根据图中数据知,相同温度时,二氧化氮含量越大压强越小,所以P1<P2;相同压强时,温度越高二氧化氮含量越大,所以T2>T1;
A.反应前后气体总质量不变,混合气体的物质的量越大,其相对分子质量越小,混合气体中二氧化氮含量越大混合气体相对分子质量越小;
B.二氧化氮浓度越大混合气体颜色越深;
C.A、B是等压条件下,且温度T2>T1;
D.相同温度下,压强越大反应速率越大.
解答 解:该反应是一个反应前后气体计量数增大的吸热反应,升高温度平衡正向移动,二氧化氮含量增大;增大压强,平衡逆向移动,二氧化氮含量减小,根据图中数据知,相同温度时,二氧化氮含量越大压强越小,所以P1<P2;相同压强时,温度越高二氧化氮含量越大,所以T2>T1;
A.反应前后气体总质量不变,混合气体的物质的量越大,其相对分子质量越小,混合气体中二氧化氮含量越大混合气体相对分子质量越小,A点二氧化氮含量大于C点,则相对分子质量A<C,故A错误;
B.二氧化氮浓度越大混合气体颜色越深,AC温度相同,压强P1<P2,则容器体积A>C,所以A点浓度小于C点,则A点颜色浅、C点颜色深,故B错误;
C.A、B是等压条件下,且温度T2>T1,所以由状态B到状态A,可以用加热的方法实现,故C正确;
D.相同温度下,压强越大反应速率越大,AC温度相同,压强P1<P2,所以反应速率A点小于C点,故D错误;
故选C.
点评 本题考查图象分析,明确纵横坐标及曲线含义是解本题关键,采用“定一议二”的方法进行分析解答,易错选项是B,注意分析容器体积大小确定气体颜色深浅,题目难度不大.

练习册系列答案
相关题目
12.下列化学用语表达正确的是( )
| A. | 次氯酸的结构式为H-Cl-O | B. | 丁烷的结构简式为CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式为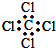 | D. | 苯的分子式为 |
10.下列说法中正确的是( )
| A. | 元素R位于周期表的IB族,其原子序数为a,则原子序数为a-3的元素位于ⅥB族 | |
| B. | 在元素周期表中114号元素的上一周期同一族元素的原子序数是82 | |
| C. | 具有相同电子层结构的主族元素离子为X2+、Y+,则最高价氧化物的水化物的碱性X>Y | |
| D. | 在周期表中金属与非金属的分界线处可以找到催化剂和耐高温、耐腐蚀的合金材料 |
17.化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )
| A. | 草木灰常与铵态氮肥混合施用,便于同时满足植物钾肥和氮肥的需求 | |
| B. | 明矾可用于净水是因为它能杀菌消毒 | |
| C. | 废旧电池应注意集中回收填埋处理 | |
| D. | 放在冰箱中的食品保质期一般较长,因为温度降低食品化学反应变质的速率减慢 |
7.某精细化工厂将棉花(主要成分是纤维素)加工成很细的颗粒结构,然后添加到食品中去,可使食品易加工成型,改变食品的口感,降低人体获得的能量等.下列说法正确的是( )
| A. | 纤维素是人体重要的营养物质 | |
| B. | 纤维素在人体中可水解成葡萄糖 | |
| C. | 纤维素不能被人体吸收,但可以促进消化 | |
| D. | 纤维素不能被所有动物吸收 |
14.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 水分子和氨气分子中,中心原子的杂化方式相同 | |
| C. | SiO2晶体结构中,存在四面体结构单元,O处于中心,Si处于4个顶角 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
11.形状记忆合金是一类具有形状记忆效应的新型功能材料,如铜铝系合金等.下列有关铜、铝的说法正确的是( )
| A. | 铝和铜均属于短周期元素 | |
| B. | CuO、Al2O3均属于碱性氧化物 | |
| C. | 大规模开发和利用的年限:铜比铝早 | |
| D. | 目前工业上获得铜和铝都采用热还原法 |
 、
、 .
. .
.
 .
.