题目内容
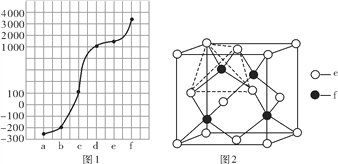
【题目】a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:图1表示的是六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为________(用元素符号表示)。
(2)元素b的单质的一个分子中含有________个σ键和_________个π键。
(3)元素c的单质的晶体堆积方式类型是_______________________;若c单质分别与氟气和氯气形成化合物甲和乙,则甲的晶格能________乙的晶格能(填“>”“<”或“=”)。
(4)元素d的基态原子的价电子排布式为__________________。
(5)元素e和f可形成化合物丙(丙的晶胞结构如图2所示),则丙的化学式为_________;丙的晶体类型为_______________,在丙中,每个e原子周围最近的e原子数目为_____,若晶胞的边长为a pm,则丙的密度为____________g·cm-3(用NA表示阿伏加德罗常数的值)。
【答案】 H<C<N 1 2 体心立方堆积 > 3d104s1 SiC 原子晶体 12 ![]()
【解析】试题分析:本题为《物质结构与性质》的选做题,主要考查元素的推断,价电子排布式的书写,电负性的比较,σ键和π键的判断,金属晶体的堆积方式,离子晶体晶格能的比较,用“均摊法”确定晶体的化学式以及晶体的计算。c、d均是热和电的良导体,c、d为金属元素,由图知d单质的熔点高于c单质,则c为Na,d为Cu;f形成的某种单质硬度最大,f单质的熔点是六种单质中最高的,f为C;H、N的单质形成分子晶体,H2的相对分子质量小于N2,H2的熔点低于N2,Si的单质形成原子晶体,根据图中熔点高低顺序,a为H,b为N,e为Si。
(1)a、b、f依次为H、N、C,非金属性:N![]() C
C![]() H,则三种元素电负性由小到大的顺序为H
H,则三种元素电负性由小到大的顺序为H![]() C
C![]() N。
N。
(2)b的单质为N2,N2的结构式为N![]() N,一个N2分子中含有1个σ键和2个π键。
N,一个N2分子中含有1个σ键和2个π键。
(3)c的单质为Na,Na属于钾型,Na的晶体堆积方式为体心立方堆积。Na单质分别与氟气和氯气形成的化合物甲和乙依次为NaF、NaCl,由于F-半径小于Cl-半径,NaF的晶格能大于NaCl的晶格能,则甲的晶格能![]() 乙的晶格能。
乙的晶格能。
(4)d为Cu,Cu的原子序数为29,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,基态Cu原子的价电子排布式为3d104s1。
(5)用“均摊法”,丙的晶胞中含e(Si)为8![]() +6
+6![]() =4,含f(C)为4,丙的化学式为SiC;丙的晶体类型为原子晶体。在丙的晶胞中,e原子构成面心立方结构,每个e原子周围最近的e原子有12个。1个晶胞的体积为(a
=4,含f(C)为4,丙的化学式为SiC;丙的晶体类型为原子晶体。在丙的晶胞中,e原子构成面心立方结构,每个e原子周围最近的e原子有12个。1个晶胞的体积为(a![]() 10-10cm)3,1mol晶胞的体积为(a
10-10cm)3,1mol晶胞的体积为(a![]() 10-10cm)3NA,1mol晶胞的质量为4
10-10cm)3NA,1mol晶胞的质量为4![]() 40g=160g,丙的密度为160g
40g=160g,丙的密度为160g![]() [(a
[(a![]() 10-10cm)3NA]=
10-10cm)3NA]= ![]() g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案