题目内容
【题目】城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式_________________________。
(2)液化石油气的主要成分是丙烷,已知丙烷、CO以及氢气燃烧的热化学方程式分别为:
C3H8(g) +5O2(g) == 3CO2(g) + 4H2O(l) △H= –2220.0 kJ·![]()
CO(g) +1/2O2(g) == CO2(g) △H= –282.6kJ·![]()
2H2(g)+O2(g) == 2H2O(l) △H= –571.6 kJ·![]()
试比较同质量的H2和C3H8燃烧,产生的热量比值约为_______。(计算结果保留小数点后一位数字)
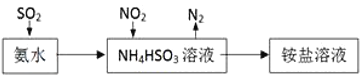
(3)氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用。
请在下图的两个空框中填上循环过程中的反应物和生成物,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。

__________________________、 ___________________________
【答案】C+H2O![]() CO+H2 2.8 :1 H2O H2、O2
CO+H2 2.8 :1 H2O H2、O2
【解析】
(1)煤炭与水蒸气在高温下反应生成一氧化碳和氢气;
(2)根据热化学方程式计算同质量的H2和C3H8燃烧产生的热量之比;
(3)根据物质转化关系及能源进行判断。
(1)煤炭与水蒸气在高温下反应生成一氧化碳和氢气,反应方程式为C+H2O![]() CO+H2;
CO+H2;
(2)根据热化学方程式可知,同质量的H2和C3H8燃烧,产生的热量比值约为![]() :
:![]() =2.8:1;
=2.8:1;
(3)在催化剂的作用下,利用太阳能将水分解生成氢气和氧气,然后该题氢氧燃料电池再将化学能转化电能,则循环过程是 。
。

【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关,键能可以简单的理解为断开1mol化学键时所吸收的能量或生成1mol化学键时所释放的能量。下表是部分化学键的键能数据:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ·mol-1 | 197 | X | 499 | 434 |
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),1mol白磷完全燃烧放出热量2378.0kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物P4O10结构如图所示,则上表中X约为

A. 410B. 335C. 360D. 188