��Ŀ����
����Ŀ���������������չ�ҵ�����ķ���CO2��NO2��SO2 �ȿ��Լ�����Ⱦ�����Ϊ����
��1����CO2��������ȼ�ϼ״���
��֪��CO2��g��+3H2��g���TCH3OH��g��+H2O��l����H=��akJmol��1��
2H2��g��+O2��g���T2H2O��l����H=��b kJmol��1��
���ʾCH3OH��g��ȼ�յ��Ȼ�ѧ����ʽΪ��_______________________��
��2��������COCl2������Ҫ����ԭ�ϣ������ھ�������ϵ���������ҵͨ��Cl2��g��+CO��g��COCl2��g����H < 0�Ʊ���ͼΪʵ���о������������ڸ����ʵ�Ũ����ʱ��仯�����ߡ��ش��������⣺

��0��6min�ڣ���Ӧ��ƽ������v��Cl2��=___________��
�ڸ÷�Ӧ��һ�δ�ƽ��ʱ��ƽ�ⳣ��Ϊ___________��10min�ı��������_____________��
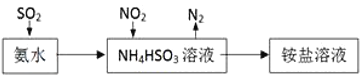
��3�����ð�ˮ���Խ�SO2��NO2���գ�ԭ����ͼ��ʾ��NO2�����յ����ӷ���ʽ��________________________________��
��4������2NO(g)��2CO(g)![]() N2(g)��2CO2(g)����1 L�ĺ����ܱ������н��з�Ӧ��������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����________(����ĸ����)��
N2(g)��2CO2(g)����1 L�ĺ����ܱ������н��з�Ӧ��������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����________(����ĸ����)��
A��c(CO)��c(CO2) B�������л��������ܶȲ���
C��2v(N2)����v(NO)�� D�������л�������ƽ��Ħ����������
���𰸡�2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ��H = +(2a-3b)kJ��mol-10.15 mol��L-1��min-130�����¶�2NO2+4HSO3- =N2+4SO42-+4H+CD
��������
(1)��CO2(g)+3H2(g)�TCH3OH(g)+H2O(l) ��H=-akJmol-1����2H2(g)+O2(g)�T2H2O(l) ��H=-bkJmol-1�����ø�˹���ɼ������3-����2�õ���ʾCH3OH(g)ȼ�յ��Ȼ�ѧ����ʽ��2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ��H=+(2a-3b)kJmol-1 ���ʴ�Ϊ��2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ��H=+(2a-3b)kJmol-1��
(2)����ͼ��֪��6minʱCl2��ƽ��Ũ��Ϊ0.3mol/L��Ũ�ȱ仯Ϊ1.2mol/L-0.3mol/L=0.9mol/L����v(Cl2)=![]() =0.15 molL-1min -1���ʴ�Ϊ��0.15molL-1min-1 ��
=0.15 molL-1min -1���ʴ�Ϊ��0.15molL-1min-1 ��
��Cl2(g)+CO(g)COCl2(g)����һ�δﵽƽ��״̬��c(CO)=0.1mol/L��c(Cl2)=0.3mol/L��c(COCl2)=0.9mol/L����Ӧ��һ�δ�ƽ��ʱ��ƽ�ⳣ��K=![]() =30��Ӱ��ƽ���ƶ����������¶ȡ�Ũ�Ⱥ�ѹǿ���÷�Ӧ�Ƿ��ȷ�Ӧ����ͼ��֪����10minʱƽ�������ƶ���ֻ�������£��ʴ�Ϊ��30�������¶ȣ�
=30��Ӱ��ƽ���ƶ����������¶ȡ�Ũ�Ⱥ�ѹǿ���÷�Ӧ�Ƿ��ȷ�Ӧ����ͼ��֪����10minʱƽ�������ƶ���ֻ�������£��ʴ�Ϊ��30�������¶ȣ�
(3)������������ǿ�������ԣ��ܹ������������������������������ӣ�������������ԭΪ���������ӷ���ʽ��2NO2+4HSO3-=N2+4SO42-+4H+���ʴ�Ϊ��2NO2+4HSO3-�TN2+4SO42-+4H+��
(4)A����Ӧ�ﵽƽ��ʱ���Ǹ����ʵ�Ũ�Ȳ��ٷ����ı�����������ȣ���A����B����Ϊ��Ӧ���ں����ܱ������н��еģ���Ӧ��������ﶼ�����壬������������������䣬������䣬�ܶȺ㶨���䣬���ܶȲ��䲻����Ϊ�ж�ƽ��ı�־����B����C����2v(N2)��=v(NO)��ʱ����Ӧ�ﵽƽ�⣬��C��ȷ��D����������������������䣬��������ʵ�����С��ƽ��Ħ��������������ʱ����Ӧ�ﵽƽ��״̬����D��ȷ���ʴ�Ϊ��CD��

 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д�




