题目内容
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
(1)常温下中和100mL pH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2 , 则V1V2 (填“>”、“=”或“<”),中和后所得溶液中离子浓度由大到小的顺序为 .
(2)用0.1000molL﹣1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如图所示.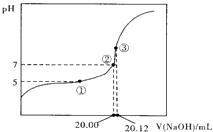
其中①点所示溶液中c(CH3COO﹣)=2c(CH3COOH),
③点所示溶液中存在:c(CH3COO﹣)+c(CH3COOH)═c(Na+).则CH3COOH的电离平衡常数Ka= , CH3COOH的实际浓度为 .
【答案】
(1)>;c(Na+)>C(CH3COO﹣)>c(OH﹣)>c(H+)
(2)2×10﹣5;0.1006mol/L
【解析】解:(1)相同温度下,酸的浓度越小其电离程度越大,所以pH=3醋酸的浓度大于pH=4醋酸浓度的10倍,100mLpH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,前者的物质的量大于后者,醋酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积V1>V2;醋酸钠是强碱弱酸盐,其溶液呈碱性,则c(OH﹣)>c(H+),再结合电荷守恒得c(Na+)>C(CH3COO﹣),醋酸根离子水解程度很小,所以溶液中离子浓度大小顺序是c(Na+)>C(CH3COO﹣)>c(OH﹣)>c(H+),所以答案是:>;c(Na+)>C(CH3COO﹣)>c(OH﹣)>c(H+);(2)根据③中物料守恒得醋酸浓度= ![]() =0.1006mol/L,A为缓冲溶液,pH=pKa﹣lgc(CH3COO﹣)/lgc(CH3COOH),5=pKa﹣lg2,10﹣5=
=0.1006mol/L,A为缓冲溶液,pH=pKa﹣lgc(CH3COO﹣)/lgc(CH3COOH),5=pKa﹣lg2,10﹣5= ![]() ,Ka=2×10﹣5 , 所以答案是:2×10﹣5;0.1006 mol/L.
,Ka=2×10﹣5 , 所以答案是:2×10﹣5;0.1006 mol/L.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案