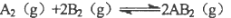题目内容
(1)铁在潮湿的空气中容易发生电化腐蚀最后生成铁锈(Fe2O3.xH2O),则发生腐蚀时正极上发生反应的电极反应式为__________________。
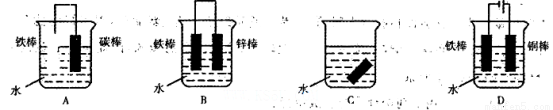
(2)下列哪些装置可防止铁棒被腐蚀__________________。
(3)在实际生产中,可在铁件的表面上镀铜防止铁被腐蚀。装置示意图如下左图:

①电镀时,镀件与电源的______________极连接,A电极对应的金属是______________(写元素名称),B电极的电极反应式是______________________。
②上右图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和
隔膜,该电池反应为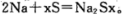 。该电池正极的电极反应式为___________________________。
。该电池正极的电极反应式为___________________________。
用该电池作电源进行上述铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为_________g。
(1)O2 + 2H2O + 4e- = 4OH-;
(2)BD
(3)①负极 铜 Cu2+ + 2e-=Cu ②xS+2e—=Sx2— 9.2
【解析】
试题分析:(1)铁在潮湿的空气中主要发生吸氧腐蚀,则发生腐蚀时正极上发生反应的电极反应式为O2 + 2H2O + 4e- = 4OH-;(2)A、该装置为原电池,铁棒作负极,发生氧化反应,加快铁棒的腐蚀,错误;B、该装置为原电池,铁棒作正极,被保护,为牺牲阳极保护法,正确;C、该装置不能防止铁棒被腐蚀,错误;D、该装置为电解池,铁棒作阴极,为阴极电保护法,正确;选BD;(3)①根据电镀池的构成:镀层金属作阳极,镀件作阴极,电解液为含有镀层金属阳离子的盐溶液知,在铁件的表面上镀铜,电镀时,镀件与电源的负极连接,A电极对应的金属是铜,B电极的电极反应式是Cu2+ + 2e-=Cu;②根据电池反应分析,硫元素的化合价降低,发生还原反应,作正极,电极反应式为xS+2e—=Sx2—;根据电镀时两极的电极反应式判断;阳极:Cu—2e- =Cu2+,阴极:Cu2+ + 2e-=Cu,及该原电池的负极反应式:Na—e-=Na+,利用电子守恒法计算;若电镀池中两电极的质量开始相同,电镀完成后二者质量差为25.6g,则转移的电子为0.4mol,则理论上该电池负极消耗的质量为9.2g。
考点:考查金属的腐蚀与防护、电解原理的应用、原电池原理及电化学计算。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案