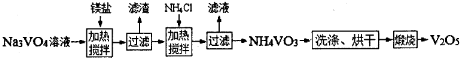
题目内容
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
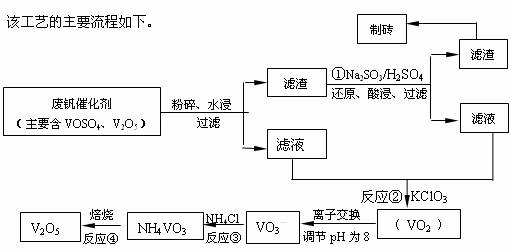
请回答下列问题:
(1)23V在元素周期表位于第 周期 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量: VO2+ + H2C2O4 + H+ → VO2+ + CO2 + ______。
短线上填写物质的化学式或离子符号后,写出配平后完整的离子方程式。 。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如下图所示。则NH4VO3在分解过程中 。
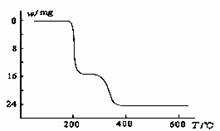
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
(1)四、VB 3V2O5+10Al ![]() 6V+5Al2O3
6V+5Al2O3
(2)将V2O5 转化为可溶性的VOSO4
(3)NH4++VO3― = NH4VO3↓
(4)2 VO2+ + H2C2O4 + 2H+ = 2 VO2+ + 2 CO2 +2 H2O;
(5) B

 全能测控期末小状元系列答案
全能测控期末小状元系列答案己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
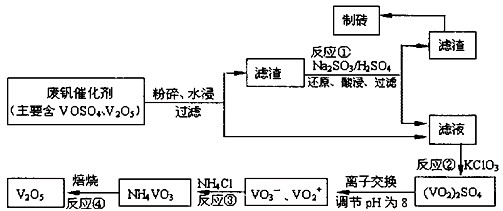
请回答下列问题
(1)工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式
(2)反应①的离子方程式是
(3)在反应②中,每生成1mol(VO2)2SO4转移电子的数目为
(4)在离子交换过程中,发生可逆反应VO2++2OH-?VO3-+H2O.
该反应的化学平衡常数K 的表达式为
(5)反应③充分反应后,分离出NH4VO3的实验所需主要玻璃仪器为

 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为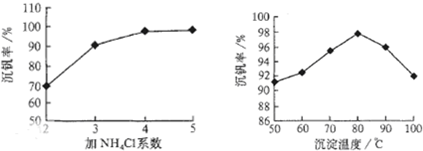
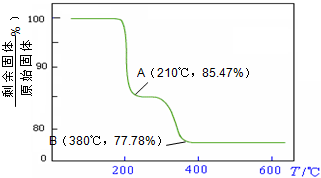 则NH4VO3在分解过程中
则NH4VO3在分解过程中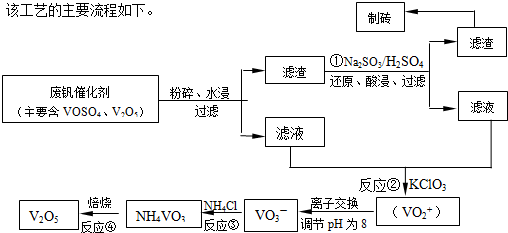
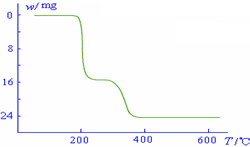 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中