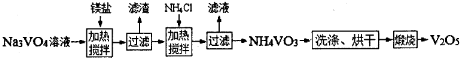
题目内容
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”.已知钒的原子序数为23,回答下列问题:(1)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价).若用氧化物的形式表示,该化合物的化学式为
(2)①测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒.请配平下列反应的化学方程式.
②上述反应其中还原剂是
分析:(1)根据各元素化合价写出相应的氧化物,氧化物之间以“?”隔开,系数配置出现的分数应化为整数,各元素原子数目比不能变化;
(3)①VO2+中V元素化合价由+5价降低为VO+中+3价,H2C2O4中碳元素由+3价升高为CO2中+4价,H2C2O4是还原剂;化合价升降的最小公倍数为2,所以VO2+系数为1,H2C2O4系数为1,再根据原子守恒(电荷守恒)配平其它物质的系数;
②0.90g草酸的物质的量为0.01mol,根据离子方程式计算参加反应的n(VO2+),据此计算参加反应的钒元素质量.
(3)①VO2+中V元素化合价由+5价降低为VO+中+3价,H2C2O4中碳元素由+3价升高为CO2中+4价,H2C2O4是还原剂;化合价升降的最小公倍数为2,所以VO2+系数为1,H2C2O4系数为1,再根据原子守恒(电荷守恒)配平其它物质的系数;
②0.90g草酸的物质的量为0.01mol,根据离子方程式计算参加反应的n(VO2+),据此计算参加反应的钒元素质量.
解答:解:(1)钾钒铀矿中的化学式为K2H6U2V2O15,用氧化物的形式表示,根据各元素化合价写出相应的氧化物,氧化物之间以“?”隔开,系数配置出现的分数应化为整数,各元素原子数目比不能变化,该化合物的化学式为K2O?V2O5?2UO3?3H2O,
故答案为:K2O?V2O5?2UO3?3H2O;
(2)①VO2+中V元素化合价由+5价降低为VO+中+3价,H2C2O4中碳元素由+3价升高为CO2中+4价,H2C2O4是还原剂;化合价升降的最小公倍数为2,所以VO2+系数为1,H2C2O4系数为1,根据原子守恒可知,VO+,系数为1,CO2系数为2,H2O系数为1,配平后离子方程式为VO2++H2C2O4═VO++2CO2+H2O,
故答案为:1;1;1;2;1;
②反应时H2C2O4中碳元素由+3价升高为CO2中+4价,所以H2C2O4是还原剂;0.90g草酸的物质的量为
=0.01mol,由方程式可知n(VO2+)=0.01mol,所以参加反应的钒元素的质量为0.01mol×51g/mol=0.51g,
故答案为:H2C2O4;0.51.
故答案为:K2O?V2O5?2UO3?3H2O;
(2)①VO2+中V元素化合价由+5价降低为VO+中+3价,H2C2O4中碳元素由+3价升高为CO2中+4价,H2C2O4是还原剂;化合价升降的最小公倍数为2,所以VO2+系数为1,H2C2O4系数为1,根据原子守恒可知,VO+,系数为1,CO2系数为2,H2O系数为1,配平后离子方程式为VO2++H2C2O4═VO++2CO2+H2O,
故答案为:1;1;1;2;1;
②反应时H2C2O4中碳元素由+3价升高为CO2中+4价,所以H2C2O4是还原剂;0.90g草酸的物质的量为
| 0.9g |
| 90g/mol |
故答案为:H2C2O4;0.51.
点评:本题考查氧化还原反应配平、计算等,难度不大,注意掌握根据得失电子守恒配平方程式.

练习册系列答案
相关题目
随着材料科学的发展,金属钒被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺.
己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如下:
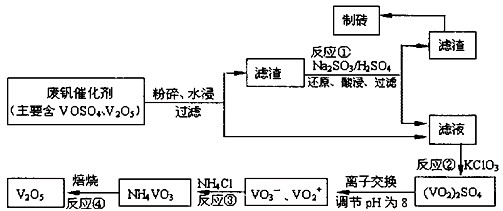
请回答下列问题
(1)工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 .
(2)反应①的离子方程式是 .
(3)在反应②中,每生成1mol(VO2)2SO4转移电子的数目为 .
(4)在离子交换过程中,发生可逆反应VO2++2OH-?VO3-+H2O.
该反应的化学平衡常数K 的表达式为 .
(5)反应③充分反应后,分离出NH4VO3的实验所需主要玻璃仪器为 ,为保证产品纯度,还应进行的操作名称是 .
己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题
(1)工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式
(2)反应①的离子方程式是
(3)在反应②中,每生成1mol(VO2)2SO4转移电子的数目为
(4)在离子交换过程中,发生可逆反应VO2++2OH-?VO3-+H2O.
该反应的化学平衡常数K 的表达式为
(5)反应③充分反应后,分离出NH4VO3的实验所需主要玻璃仪器为

 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为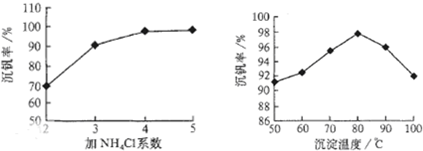
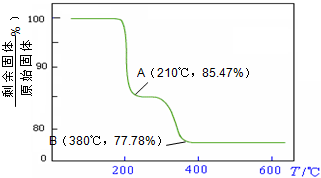 则NH4VO3在分解过程中
则NH4VO3在分解过程中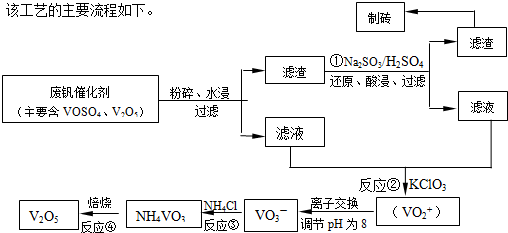
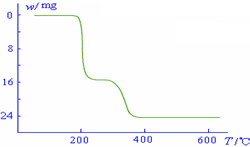 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中