题目内容
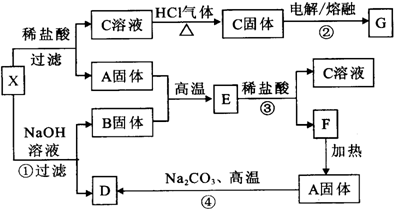
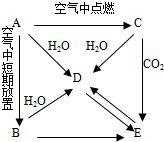
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.
请回答下列问题:
(1)写出A、E、B的化学式:
A______,E______,B______.
(2)写出C溶液转化为C固体的过程中,HCl气流的作用:______.
(3)写出①、③、④反应的化学方程式,(若是离子反应写离子方程式)
①______;
③______;
④______.
(4)将SO2气体分别通入下列溶液写出对应的实验现象
①BaCl2溶液______;
②Ba(NO3)2溶液______;
⑨FeCl3溶液______.
请回答下列问题:
(1)写出A、E、B的化学式:
A______,E______,B______.
(2)写出C溶液转化为C固体的过程中,HCl气流的作用:______.
(3)写出①、③、④反应的化学方程式,(若是离子反应写离子方程式)
①______;
③______;
④______.
(4)将SO2气体分别通入下列溶液写出对应的实验现象
①BaCl2溶液______;
②Ba(NO3)2溶液______;
⑨FeCl3溶液______.

X中两种氧化物混合物中,A能与NaOH溶液反应但不能与盐酸反应,应为SiO2,可知D为Na2SiO3,B固体可与盐酸但不能与NaOH溶液反应,生产C固体可用电解法冶炼金属,应为MgCl2,可知B为MgO,G为Mg,E为MgSiO3,F为H2SiO3,
(1)由上述分析可知,A为SiO2,E为MgSiO3,B为MgO,故答案为:SiO2;MgSiO3;MgO;
(2)因镁离子水解,则C溶液转化为C固体的过程中,HCl气流的作用抑制氯化镁水解,故答案为:抑制氯化镁水解;
(3)①的离子反应为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
③的离子反应为MgSiO3+2H+=H2SiO3↓+Mg2+,故答案为:MgSiO3+2H+=H2SiO3↓+Mg2+;
④的化学反应为SiO2+Na2CO3
Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3
Na2SiO3+CO2↑;
(4)①因盐酸的酸性大于亚硫酸的酸性,则二者不反应,现象为无明显现象,故答案为:无明显现象;
②二者发生氧化还原反应生成硫酸钡沉淀和NO,则观察到产生白色沉淀,有无色气体产生,该气体遇空气变为红棕色,
故答案为:产生白色沉淀,有无色气体产生,该气体遇空气变为红棕色;
③二者发生氧化还原反应生成亚铁离子,则观察到溶液由棕黄色变为浅绿色,故答案为:溶液由棕黄色变为浅绿色.
(1)由上述分析可知,A为SiO2,E为MgSiO3,B为MgO,故答案为:SiO2;MgSiO3;MgO;
(2)因镁离子水解,则C溶液转化为C固体的过程中,HCl气流的作用抑制氯化镁水解,故答案为:抑制氯化镁水解;
(3)①的离子反应为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
③的离子反应为MgSiO3+2H+=H2SiO3↓+Mg2+,故答案为:MgSiO3+2H+=H2SiO3↓+Mg2+;
④的化学反应为SiO2+Na2CO3
| ||
| ||
(4)①因盐酸的酸性大于亚硫酸的酸性,则二者不反应,现象为无明显现象,故答案为:无明显现象;
②二者发生氧化还原反应生成硫酸钡沉淀和NO,则观察到产生白色沉淀,有无色气体产生,该气体遇空气变为红棕色,
故答案为:产生白色沉淀,有无色气体产生,该气体遇空气变为红棕色;
③二者发生氧化还原反应生成亚铁离子,则观察到溶液由棕黄色变为浅绿色,故答案为:溶液由棕黄色变为浅绿色.

练习册系列答案
相关题目
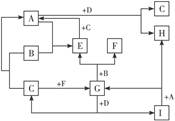

 (“→”表示一步完成)关系转化的是( )
(“→”表示一步完成)关系转化的是( )