题目内容
【题目】某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2常温下是深红棕色液体),设计了如下流程图:
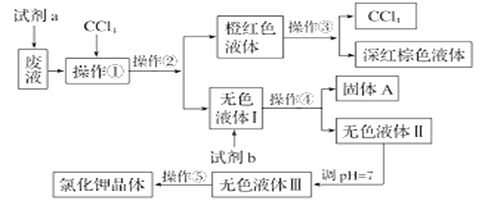
请根据流程图,回答相关问题:
(1)若试剂a为H2O2溶液(H+),已知氧化性:H2O2>Br2
①写出废液中的某阴离子和a发生反应的离子方程式为:__________________________;
②每消耗0.2mol H2O2,反应转移的电子为______mol;
(2)为了除去无色液体I中的Ca2+、Mg2+、SO42-,试剂b可选择:KOH、BaCl2、K2CO3溶液,其添加顺序不正确的是(_______)
A、KOH、BaCl2、K2CO3 B、BaCl2、KOH、K2CO3
C、BaCl2、K2CO3 、KOH D、KOH、K2CO3 、BaCl2
(3)用盐酸调pH=7(中性)是为了除去杂质离子___和___,以提高氯化钾晶体的纯度;
(4)操作①②③④⑤对应的名称分别是:____、分液、_____、过滤、______。
【答案】H2O2+2Br-+2H+=Br2+2H2O 0.4 D OH- CO32- 萃取 蒸馏 蒸发结晶
【解析】
根据图示可知,制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,然后加入四氯化碳后通过萃取、分液分离出溴,通过操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH萃取碳酸根离子、氢氧根离子,得到无色溶液Ⅲ。
(1) a为H2O2溶液(H+),具有氧化性,能把Br-氧化成Br2,自身被还原成水,反应的离子方程式是H2O2+2Br-+2H+=Br2+2H2O;消耗0.2mol H2O2,反应转移的电子为0.2mol×2×1=0.4mol;
(2)用KOH溶液与Ca2+、Mg2+反应生成Ca(OH)2、Mg(OH)2,除去Mg2+和大部分Ca2+,用BaCl2溶液与SO42-反应生成BaSO4而除去Ba2+,最后用饱和的K2CO3除去余下的少量Ca2+和后来加入的Ba2+,此处不能选用Na2CO3溶液,否则会引入新的Na+,K2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+;所以所需的试剂按滴加顺序依次为:BaCl2、KOH、K2CO3或者BaCl2、K2CO3、KOH,故不正确的选:D;
(3)由于加入的KOH、K2CO3是过量的,所以要调节pH除去多余的OH-、CO32-;
(4)由流程图知,无色液体Ⅰ中含有K+、Cl-、Br- Ca2+、Mg2+、SO42-无色液体Ⅲ中只含有K+、Cl-,则试剂b的作用是除去Ca2+、Mg2+、SO42-;操作①是萃取,操作②是将互不相溶的两种液体分开分液,操作③是将沸点不同、互溶的两液体分开蒸馏,操作④是将溶液与沉淀分开过滤,操作⑤是将KCl从其水溶液中提取出来结晶,操作①、②、③、④、⑤的名称是:萃取、分液、蒸馏、过滤、蒸发结晶。

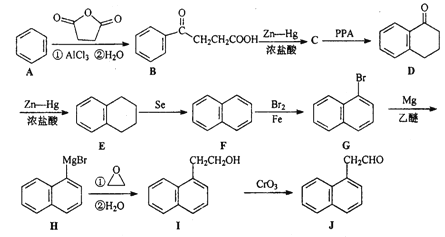
【题目】实验室以苯甲醛为原料制备间溴苯甲酸的反应如下:
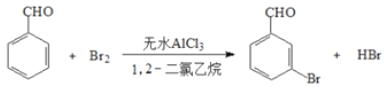
已知:(1)间溴苯甲醛温度过高时易被氧化
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
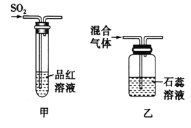
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如下图所示)缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
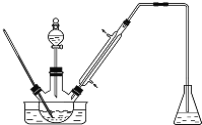
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液、有机层用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4·nH2O晶体
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是____________,锥形瓶中应为__________(填化学式)溶液
(2)步骤1反应过程出,为提高原料利用率,适宜的温度范围内(填序号)____________
A.>299℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10%NaHCO3溶液洗涤,是为了除去溶于有机层的____________(填化学式)
(4)步骤3中加入无水MgSO4固体的作用是___________________。
(5)步骤4中采用减压蒸馏,是为了防止_______________________________________。
(6)若实验中加入5.3g苯甲醛,得到3.7g间溴苯甲醛,则间溴苯甲醛产率为______________。