题目内容
【题目】南京大学研究发现TiO2-x晶体中存在的晶体缺陷有利于提高导电性和提供镁离子储位,可用作新型镁电池负极材料,该电池的工作原理如图所示。下列说法正确的是( )
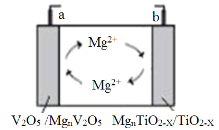
A.放电时,a为电池负极
B.充电时,Mg2+向b电极移动
C.放电时,a极的电极式为nMg2++V2O5+2ne-=MgnV2O5
D.充电时,b极的电极式为MgnTiO2-x-2ne-=nMg2++TiO2-x
【答案】BC
【解析】
TiO2-x晶体中存在的晶体缺陷有利于提高导电性和提供镁离子储位,可用作新型镁电池负极材料,放电时,b为负极,负极上MgnTiO2-x失电子,a为正极;充电时,b与外接电源的负极相连为阴极,a与外接电源的正极相连为阳极,充电时,阳离子向阴极移动,据此分析解答。
A.根据分析,放电时,b为电池负极,故A错误;
B.充电时为电解池,阳离子向阴极移动,根据分析,b与外接电源的负极相连为阴极,则Mg2+向b电极移动,故B正确;
C.放电时,a极为正极,得电子,发生还原反应,电极式为:nMg2++V2O5+2ne-=MgnV2O5,故C正确;
D.充电时,b与外接电源的负极相连为阴极,发生还原反应,电极式为:nMg2++TiO2-x+2ne-=MgnTiO2-x,故D错误;
答案选BC。

【题目】化合物A、B是中学常见的物质,其阴阳离子可从表中选择.
阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
阴离子 | OH﹣、I﹣、NO3﹣、AlO2﹣、HCO3﹣、HSO4﹣ |
(1)若A的水溶液为无色,B的水溶液呈碱性,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀及能使湿润的红色石蕊试纸变蓝的气体,则:
①A中的化学键类型为_________(填“离子键”、“共价键”).
②A、B溶液混合后加热呈中性,该反应的离子方程__________________________ .
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则:
①A的化学式为__________________________ .
②经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)
Ⅰ._______________________.Ⅱ._________________________.
③请用一简易方法证明上述溶液变黄的原因_________________________.
④利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_.







