题目内容
【题目】研究 CO2的利用对促进低碳社会的构建具有重要意义。
(1)一定条件下,在 CO2 与足量碳反应所得平衡体系中加入 H2 和适当催化剂,有下列反应发生:CO(g)+3H2(g) ![]() CH4(g)+H2O(g) H1=-206.2kJ/mol ;CO(g)+H2O(g)
CH4(g)+H2O(g) H1=-206.2kJ/mol ;CO(g)+H2O(g)![]() CO2(g)+H2(g)H2若 CO2 和 H2 反应生成 0.1mol CH4(g)和一定量的 H2O(g), 整个过程中放出的热量为 16.5kJ, 则△H2=__________。
CO2(g)+H2(g)H2若 CO2 和 H2 反应生成 0.1mol CH4(g)和一定量的 H2O(g), 整个过程中放出的热量为 16.5kJ, 则△H2=__________。
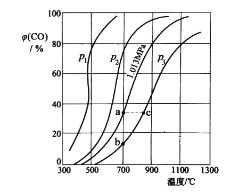
(2)为研究 CO2 与 CO 之间的转化。让一定量的 CO2 与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H。 测得压强、温度对 CO 的体积分数(φ(CO)%)的影响如图所示:
2CO(g) H。 测得压强、温度对 CO 的体积分数(φ(CO)%)的影响如图所示:
回答下列问题:
① p1、p2、p3 的大小关系是__________,图中 a、b、c 三点对应的平衡常数大小关系是__________(用 Ka、Kb、Kc 表示)。
② 900 ℃、1.013 MPa 时,1 mol CO2 与足量碳反应达平衡后容器的体积为VL,CO2 的转化率为__________,(保留一位小数)该反应的平衡常数 K=__________。
③将②中平衡体系温度降至 640 ℃,压强降至 0.1013 MPa,重新达到平衡后 CO2 的体积分数为 50%。条件改变时,正反应和逆反应速率如何变化?__________,二者之间有何关系?__________。
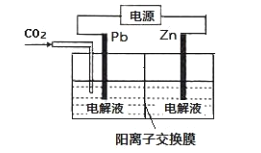
(3)CO2 可用于工业制备草酸锌,其原理如下图所示(电解液不参加反应),Zn 电极是__________极。已知在 Pb 电极区得到 ZnC2O4,则 Pb 电极上的电极反应式为__________。
【答案】-41.2 kJ/mol p1<p2<p3 Ka=Kb<Kc 66.7% ![]() mol/L 正反应和逆反应速率均减小 v(正)<v(逆) 阳 2CO2+2e-=C2O42-
mol/L 正反应和逆反应速率均减小 v(正)<v(逆) 阳 2CO2+2e-=C2O42-
【解析】
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:① CO(g)+3H2(g)CH4(g)+H2O(g)△H1=-206.2 kJ/mol;②CO(g)+H2O(g)CO2(g)+H2(g)△H2;若H2还原CO2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则H2还原CO2生成1molCH4(g)和一定量的H2O(g),放出热量为165kJ,该反应的热化学方程式为:③CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H3=-165kJ/mol,根据盖斯定律,①-③可得②,据此计算△H2;
(2)①反应C(s)+CO2(g)2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大;化学平衡常数只随温度的改变而改变;
②900℃、1.013MPa时,平衡时CO的体积分数为80%,计算CO2转化的量,转化率就是转化的量与起始量比值的百分数,将各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
③根据改变条件前后CO2的体积分数的变化判断,根据反应商判断化学反应的方向;
(3)Zn在阳极上失电子生成锌离子,Pb电极上CO2得电子生成C2O42-。
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:①CO(g)+3H2(g)CH4(g)+H2O(g)△H1=-206.2 kJ/mol;②CO(g)+H2O(g)CO2(g)+H2(g)△H2;若H2还原CO2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则H2还原CO2生成1molCH4(g)和一定量的H2O(g),放出热量为165kJ,该反应的热化学方程式为:③CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H3=-165kJ/mol,根据盖斯定律,①-③可得②:②CO(g)+H2O(g)CO2(g)+H2(g)△H2=(206.2 kJ/mol)(165kJ/mol)=41.2kJ/mol;
故答案为:41.2kJ/mol;
(2)①反应C(s)+CO2(g)2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大,减小压强有助于化学平衡正向移动,表明低压强对应着高的CO体积分数,则p1、p2、p3的大小关系是:p1<p2<p3;化学平衡常数只随温度的改变而改变,升高温度,正反应趋势增大,化学平衡常数增大,则a、b、c三点对应的平衡常数大小关系是:Ka=Kb<Kc;
故答案为:p1<p2<p3;Ka=Kb<Kc;
②900℃、1.013MPa时,设反应转化的CO2的物质的量为xmol,则平衡时n(CO)=2x,n(CO2)=1x,平衡时CO的体积分数为80%,则![]() ×100%=80%,解得:x=2/3,则CO2的转化率为:2/3mol/1mol×100%=66.7%;平衡时,c(CO)=
×100%=80%,解得:x=2/3,则CO2的转化率为:2/3mol/1mol×100%=66.7%;平衡时,c(CO)= ![]() =
=![]() ,c(CO2)=
,c(CO2)= ![]() =
=![]() ,则该反应的平衡常数K=
,则该反应的平衡常数K= 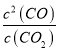 =
=![]() mol/L;
mol/L;
故答案为:66.7%;![]() mol/L;
mol/L;
③反应C(s)+CO2(g)2CO(g)是吸热反应,气体分子数增大的反应,降低压强,升高温度均有利于反应正向进行,将(2)中平衡体系温度降至640℃,压强降至0.1013 MPa,降低温度减小压强,均使正逆反应速率减小;重新达到平衡后CO2的体积分数为50%,设反应转化的CO2的物质的量为ymol,则平衡时n(CO2)=1y,n(CO)=2y,则:![]() =50%,可得y=
=50%,可得y=![]() ,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,化学平衡向逆反应方向移动,所以v(逆)>v(正);
,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,化学平衡向逆反应方向移动,所以v(逆)>v(正);
故答案为:正逆反应速率均减小;>;
(3)利用电化学还原CO2制取ZnC2O4,则Zn失电子,所以Zn在阳极上失电子生成锌离子,即锌与正极相连为阳极;Pb电极上CO2得电子生成C2O42,则其电极反应为:2CO2+2e=C2O42-;
故答案为:阳;;2CO2+2e-=C2O42-。