题目内容
【题目】25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10—10),下列说法正确的是
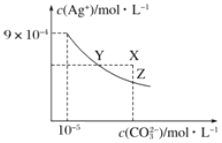
A.根据图示可计算出Ksp(Ag2CO3)=9×10—9
B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点
C.反应Ag2CO3(s)+2Cl—(aq)![]() 2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
D.将0.001mol/LAgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CO3的混合溶液,CO32—先沉淀
【答案】C
【解析】
A.Ag2CO3的溶度积常数为Ksp(Ag2CO3)=c2(Ag+)c(CO32-),根据图象提供的数据计算;
B.图象上Y点表示离子积Qc=Ksp,达到沉淀溶解平衡,X点的含义为离子积Qc>Ksp,反应向生成沉淀的方向进行,据此分析;
C.反应Ag2CO3(s)+2Cl-(aq)2AgCl(s)+CO32-(aq),根据多重平衡规则计算该反应的平衡常数K;
D.在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,根据AgCl和Ag2CO3的Ksp计算二者形成沉淀分别需要的Cl-和CO32-的浓度,据此判断产生沉淀的顺序。
A.Ag2CO3的溶度积常数为Ksp(Ag2CO3)=c2(Ag+)c(CO32-),根据图象,c(Ag+)=9×10-4mol/L,c(CO32-)=10-5mol/L,则Ksp(Ag2CO3)=c2(Ag+)c(CO32-)=(9×10-4)2×10-5=8.1×10-12,故A错误;
B.图象上Y点表示离子积Qc=Ksp,达到沉淀溶解平衡,X点的含义为离子积Qc>Ksp,反应向生成沉淀的方向进行,向Ag2CO3饱和溶液中加入K2CO3饱和溶液,增大了溶液中CO32-的浓度,使得沉淀溶解平衡向生成沉淀的方向进行,溶液中c(Ag+)的浓度减小,不可以使Y点移到X点,故B错误;
C.反应Ag2CO3(s)+2Cl-(aq)2AgCl(s)+CO32-(aq),化学平衡常数为K=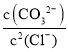 =
=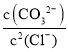 ×
×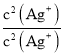 =
=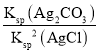 =
=![]() =2.5×108,故C正确;
=2.5×108,故C正确;
D.在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,产生AgCl沉淀需要的Cl-的浓度为c(Cl-)=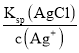 =
=![]() =1.8×10-7mol/L,产生Ag2CO3沉淀需要CO32-的浓度为c(CO32-)=
=1.8×10-7mol/L,产生Ag2CO3沉淀需要CO32-的浓度为c(CO32-)=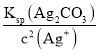 =
=![]() =8.1×10-6mol/L,因此产生AgCl沉淀所需要的Cl-浓度更小,则优先产生AgCl沉淀,故D错误;
=8.1×10-6mol/L,因此产生AgCl沉淀所需要的Cl-浓度更小,则优先产生AgCl沉淀,故D错误;
故选C。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】现有下列九种物质:①H2 ②铝 ③Na2O2 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 能导电 | 非电解质 | 电解质 |
属于该类的物质 | ___ | ___ | ___ |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(3)过量的⑦滴加到⑨的溶液中的离子方程式为___,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为___。
(4)④与③充分反应的化学方程式为:___,当转移NA电子,生成标况下气体的体积为___。
(5)②与⑧发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是___(填化学式),还原剂与氧化剂的物质的量之比是___,当有5.4gAl发生反应时,转移电子的物质的量为___。