题目内容
【题目】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
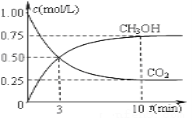
在体积为1L的固定容积的密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如右图所示。试回答:
①0—10 min内,氢气的平均反应速率为___________mol/(L·min)。
②下列选项能说明该反应已达到平衡状态的是 。
A.v(H2)=3v(CO2)
B.容器内气体密度不变
C.单位时间内,形成2molC=O,同时断裂3molH—H
D.容器内温度不变
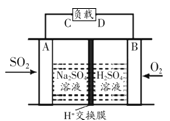
(3)脱硫。有学者想利用如下图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。则电子流出的电极为____(用A或B表示),A极的电极反应式为_ ___。
【答案】(1)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) ΔH=-867 kJ/mol;
(2)① 0.225;②C、D;(3)①A ;SO2-2e-+2H2O=SO42-+4H+;
【解析】
试题分析:(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol ①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol ②
根据盖斯定律,①+②可得甲烷直接将NO2还原为N2的热化学方程式为:2CH4(g)+4NO2(g)=2CO2(g)+4H2O(g)+2N2(g) ΔH=-1734 kJ/mol,所以甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) ΔH=-867 kJ/mol;
(2)①由CO2和CH3OH(g)的浓度随时间变化图线可知:

故0~10 min内,氢气的平均反应速率为![]() ;
;
②A.v(H2)=3v(CO2)不能说明正逆反应速率相等,则不一定达到平衡状态,A错误;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内气体密度不变不能说明反应达到平衡状态,B错误;C.单位时间内,形成2molC=O,同时断裂3molH—H,说明正逆反应速率相等,达到了平衡状态,C正确;D.容器内温度不变说明热量不再发生变化,因此反应达到平衡状态,D正确,答案选CD。
(3)①A、B是惰性电极,A极上SO2失去电子,发生氧化反应生成SO42-,B极上O2得到电子并与H+结合生成水,因此电子流出的是A极,电子流入的是B极;A极的电极反应式为:SO2-2e-+2H2O=SO42-+4H+。