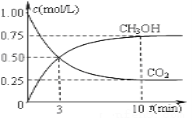
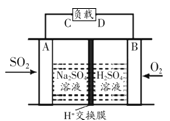
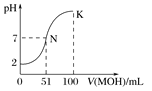
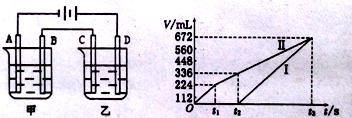
题目内容
【题目】海水开发利用的部分过程如图所示。下列说法错误的是
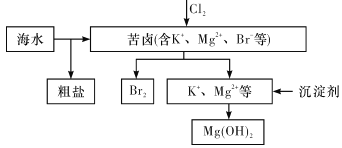
A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
【答案】C
【解析】试题分析:A.氯气具有强氧化性,能把溴离子氧化为单质溴,因此向苦卤中通入Cl2是为了提取溴,A项正确;B.粗盐中的钙离子、镁离子等可采用沉淀法除去,所得氯化钠溶液可采用重结晶等过程提纯,B项正确;C.工业生产常选用来源更广泛、价格更便宜的石灰乳作为沉淀剂,用氢氧化钠不经济,C项错误;D.富集溴一般先用空气和水蒸气吹出单质溴,SO2具有还原性,能被溴氧化,因此再用SO2将其还原吸收,D项正确,答案选C。

练习册系列答案
相关题目