题目内容
(1)工业合成氨技术的反应原理是:N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图1所示,回答下列问题:
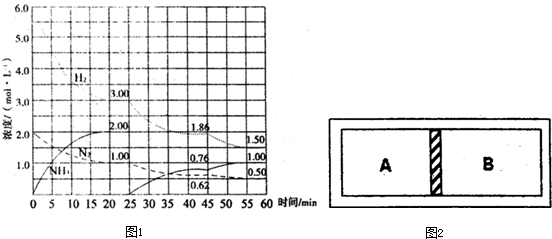
①计算反应在第一次平衡时平衡常数K=______(保留二位小数)
②产物NH3在5~10min、20~25min和45~50min时平均反应速率[平均反应速率分别以v1、v2、v3表示]从大到小排列次序为______.
③在45min时,采取的措施是______;
(2)如图2是一个体积固定的恒温密闭容器,正中间有一个可以滑动的隔板将容器隔成A、B两室.A室放入H2和O2共5mol,B室放入H2和N2共5mol,使隔板恰好处于正中间.
①控制一定条件,只使A室气体充分反应,此时隔板左移,待反应完成且密闭容器温度恒定(大于120℃)后,A室气体体积是B室体积的
.计算原H2和O2的体积比为______.
②再控制一定条件,使H2和N2发生反应(正反应放热).当密闭容器温度恒定(大于120℃)且达到平衡时,隔板右移恰好回到正中间,若加入的N2为1mol,则N2的转化率为______,若加入的N2为xmol,则x的取值范围是______.
| 催化剂 |
| 高温高压 |

①计算反应在第一次平衡时平衡常数K=______(保留二位小数)
②产物NH3在5~10min、20~25min和45~50min时平均反应速率[平均反应速率分别以v1、v2、v3表示]从大到小排列次序为______.
③在45min时,采取的措施是______;
(2)如图2是一个体积固定的恒温密闭容器,正中间有一个可以滑动的隔板将容器隔成A、B两室.A室放入H2和O2共5mol,B室放入H2和N2共5mol,使隔板恰好处于正中间.
①控制一定条件,只使A室气体充分反应,此时隔板左移,待反应完成且密闭容器温度恒定(大于120℃)后,A室气体体积是B室体积的
| 4 |
| 5 |
②再控制一定条件,使H2和N2发生反应(正反应放热).当密闭容器温度恒定(大于120℃)且达到平衡时,隔板右移恰好回到正中间,若加入的N2为1mol,则N2的转化率为______,若加入的N2为xmol,则x的取值范围是______.
(1)①第一次达到平衡常数时,氨气的浓度为:2.00mol/L,氢气浓度为:3.00mol/L,氮气的浓度为:1.00mol/L,
第一次平衡时平衡常数K=
≈0.15,
故答案为:0.15;
②5~10min氨气的浓度变化大于0.5mol/L,20~25min氨气浓度变化为0,45~50min氨气的浓度变化小于0.50.5mol/L,时间变化为5min,由v=
可知,反应速率关系为:v1>v3>v2,
故答案为:v1>v3>v2;
③45min时,氨气的浓度增大,氮气、氢气的浓度减小,化学平衡平衡向着正向移动,该反应是放热反应,说明降低了温度,
故答案为:降低温度;
(2)①A室气体体积是B室体积的
,A、B的压强相同,B的物质的量为5mol且不变,所以A反应后的物质的量为4mol,反应后气体减小了1mol,
2H2 +O2
2H2O△n
2 1 2 1
2mol1mol 1mol
反应消耗的氢气的物质的量为2mol、氧气的物质的量为1mol,所以氢气和氧气的物质的量有两种情况,
或
,所以原H2和O2的体积比为2:3或4:1,
故答案为:2:3或4:1;
②达到平衡时,隔板右移恰好回到正中间,根据①可知,达到平衡时B中气体的总物质的量为4mol,气体的物质的量减小了1mol,
根据反应N2+3H2 ?2NH3 △n
13 2 2
0.5mol1.5mol1mol
反应消耗氮气的物质的量为0.5mol、氢气为1.5mol,
加入的N2为1mol,则N2的转化率为:
×100%=50%;
氮气的物质的量最少为0.5mol,但是必须大于0.5mol,氮气最大的物质的量为3.5mol,
剩余氮气的取值范围为:0.5<x<3.5,
故答案为:50%;0.5<x<3.5.
第一次平衡时平衡常数K=
| 2.002 |
| 1.00×3.003 |
故答案为:0.15;
②5~10min氨气的浓度变化大于0.5mol/L,20~25min氨气浓度变化为0,45~50min氨气的浓度变化小于0.50.5mol/L,时间变化为5min,由v=
| △c |
| △t |
故答案为:v1>v3>v2;
③45min时,氨气的浓度增大,氮气、氢气的浓度减小,化学平衡平衡向着正向移动,该反应是放热反应,说明降低了温度,
故答案为:降低温度;
(2)①A室气体体积是B室体积的
| 4 |
| 5 |
2H2 +O2
| ||
2 1 2 1
2mol1mol 1mol
反应消耗的氢气的物质的量为2mol、氧气的物质的量为1mol,所以氢气和氧气的物质的量有两种情况,
|
|
故答案为:2:3或4:1;
②达到平衡时,隔板右移恰好回到正中间,根据①可知,达到平衡时B中气体的总物质的量为4mol,气体的物质的量减小了1mol,
根据反应N2+3H2 ?2NH3 △n
13 2 2
0.5mol1.5mol1mol
反应消耗氮气的物质的量为0.5mol、氢气为1.5mol,
加入的N2为1mol,则N2的转化率为:
| 0.5mol |
| 1mol |
氮气的物质的量最少为0.5mol,但是必须大于0.5mol,氮气最大的物质的量为3.5mol,
剩余氮气的取值范围为:0.5<x<3.5,
故答案为:50%;0.5<x<3.5.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
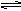 2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为( )
2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为( )  H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是 。
H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是 。