题目内容
4.关于氮的变化关系示意图如图:则下列说法不正确的是( )
| A. | 路线①②③是工业生产硝酸的主要途径 | |
| B. | 路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 | |
| C. | 上述所有反应都是氧化还原反应 | |
| D. | 上述反应中①②③均属于氮的固定 |
分析 A.工业上生产硝酸的流程是:氮气和氢气生成氨气,氨气与氧气反应生成一氧化氮和水,一氧化氮与氧气反应生成二氧化氮、二氧化氮被水吸收生成硝酸和一氧化氮;
B.自然雷电固氮原理是,在放电条件下,氮气和氧气生成一氧化氮,一氧化氮性质不稳定,迅速被空气中的氧气氧化为二氧化氮,二氧化氮溶于水生成硝酸;
C.氧化还原反应的特征是化合价的升降,可从元素的化合价是否发生变化的角度判断是否属于氧化还原反应;
D.氮的固定是指空气中游离态的氮转化为化合态的氮的过程.
解答 解:A.工业上生产硝酸的流程是:氮气和氢气生成氨气,氨气与氧气反应4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O路线①,一氧化氮与氧气反应2NO+O2=2NO2路线②,二氧化氮被水吸收3NO2+H2O═2HNO3+NO路线③,路线①②③是工业生产硝酸的主要途径,故A正确;
B.在放电条件下,氮气和氧气发生化合反应:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO路线Ⅰ;NO不稳定,易被氧气氧化为二氧化氮:2NO+O2═2NO2路线Ⅱ,二氧化氮溶于水生成硝酸:3NO2+H2O═2HNO3+NO路线Ⅲ,故B正确;
C.从氮的变化关系图可知:N从N2(0价)→NO(+2价)→NO2(+4价)→HNO3(+5价),都是氧化还原反应,故C正确;
D.上述反应中①空气中的氮气转变为含氮化合物,符合氮的固定的定义,属于氮的固定,②③含氮化合物转变为其它物质,是氮的化合物之间的转化,不是氮的固定,故D错误;
故选D.
点评 本题考查了氮及其化合物的性质及转化关系,题目难度中等,明确工业上生产硝酸的原理、雷电固氮的原理是解答的关键,注意熟练掌握氮及其化合物性质.

| A. | 溴 | B. | 铀 | C. | 氯化镁 | D. | 氢氧化钠 |
| A. | 正丁烷和异丁烷的熔点、沸点各不相同 | |
| B. | 乙醛和丙烯醛(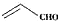 )与H2充分反应后的产物是同系物 )与H2充分反应后的产物是同系物 | |
| C. | 某有机物燃烧生成等物质的量的CO2和H2O,该有机物的通式一定为CnH2n | |
| D. | 用质谱法测定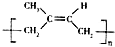 的平均相对分子质量,可得其聚合度 的平均相对分子质量,可得其聚合度 |
| A. | 丙烯分子里碳氢原子的个数比为1:2 | |
| B. | 丙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 丙烯能使酸性KMnO4溶液褪色 | |
| D. | 丙烯易与溴水发生加成反应,且1 mol乙烯完全加成需消耗1 mol溴单质 |
| A. | 植物通过光合作用将CO2转化成葡萄糖是太阳能转变成热能的过程 | |
| B. | 油脂属于酯类化合物,油脂可能使溴水褪色 | |
| C. | 萄糖与果糖互为同分异构体,淀粉与纤维素互为同系物 | |
| D. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
(2)某元素最高价氧化物的水化物酸性最强,该酸的化学式为HClO4,某元素的气态氢化物水溶液呈碱性,该氢化物的化学式为NH3;
(3)最不活泼的元素,其原子结构示意图为
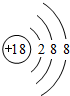 ;
;(4)写出元素④的单质与元素③的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O=AlO2-+3H2↑;
(5)写出一条能够说明元素⑥的非金属性强于⑤的依据:高氯酸的酸性比硫酸的酸性强.
| A. | 等体积的甲烷与氯气在光照条件下的取代反应 | |
| B. | 丙烯与氯化氢的加成反应 | |
| C. | CH3-CH(OH)-CH3在浓硫酸作用下的消去反应 | |
| D. | 甲苯与液溴在溴化铁做催化剂条件下的取代反应 |
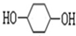 的路线如下所示,请按要求作答:
的路线如下所示,请按要求作答:
 )
) ,F
,F .
.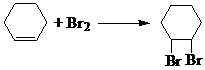 ;④
;④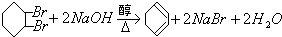 .
.