题目内容
1.将铜片、锌片与稀硫酸设计成原电池,下列说法错误的是( )| A. | 电子由锌片流出 | |
| B. | 锌比铜活泼,所以锌作正极 | |
| C. | 溶液中c(H+)减小 | |
| D. | 当有6.5g锌溶解时电路中转移的电子数是0.2NA |
分析 铜-锌-稀硫酸构成的原电池中,锌是负极,负极上锌失电子发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,结合原电池定义分析解答.
解答 解:A、铜-锌-稀硫酸构成的原电池中,锌是负极,电子从负极沿导线流向正极,故A正确;
B、铜-锌-稀硫酸构成的原电池中,活泼金属锌是负极,故B错误;
C、铜为正极,正极上氢离子得电子发生还原反应,c(H+)减小,故C正确;
D、锌是负极,负极上锌失电子生成锌离子,有6.5g锌溶解时电路中转移的电子数是0.2NA,故D正确;
故选B.
点评 本题考查原电池原理,明确正负极上发生的反应是解本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.有关如图所示的有机物的说法不正确的是( )
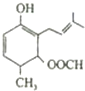

| A. | 该有机物可以与NaOH溶液反应 | |
| B. | 该有机物的分子式为C13H19O3 | |
| C. | 该有机物既可以发生氧化反应又能发生还原反应 | |
| D. | 该有机物和丙三醇不互为同系物 |
16.下列事实不能用元素周期律解释的是( )
| A. | 相对原子质量:Ar>K | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 酸性:HNO3>H3PO4 | D. | 元素非金属性:Cl>S |
6.已知分子式为C10H14的有机物,该有机物不能与溴水发生加成反应,分子中只有一个烷基,此烷基的结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
13.可逆反应A(g)+3B(g)?2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率最大的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.3 mol/(L•min) | ||
| C. | v(C)=0.2 mol/(L•min) | D. | v(D)=0.1 mol/(L•min) |
10.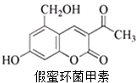 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如图.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如图.下列对假蜜环菌甲素的性质叙述正确的是( )
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如图.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如图.下列对假蜜环菌甲素的性质叙述正确的是( )| A. | 假蜜环菌甲素可以发生消去反应 | |
| B. | 1 mol假蜜环菌甲素可与 6 mol H2 发生加成反应 | |
| C. | 假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 | |
| D. | 假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
11.下列关于纯净物、混合物、强电解质、弱电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 福尔马林 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 油酯 | 淀粉 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D | 重水 | 纤维素 | 氯化钠 | 次氯酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |

 ;
; 或
或 .
.