题目内容
16.下列事实不能用元素周期律解释的是( )| A. | 相对原子质量:Ar>K | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 酸性:HNO3>H3PO4 | D. | 元素非金属性:Cl>S |
分析 A.相对原子质量的大小与原子序数有关;
B.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.同周期元素从左到右,元素的金属性逐渐减弱.
解答 解:A.相对原子质量的大小与原子序数有关,随原子序数的增大而增大,存在周期性的变化,不能用元素周期律解释,故A选;
B.Na、Mg位于周期表相同周期,金属性Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,能用元素周期律解释,故B不选;
C.非金属性N>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,能用元素周期律解释,故C不选;
D.同周期元素从左到右,元素的非金属性逐渐增强,能用元素周期律解释,故D不选.
故选:A.
点评 本题侧重于元素周期律的理解与应用的考查,注意把握元素周期律的递变规律以及相关知识的积累,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
7.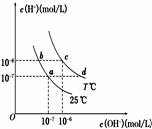 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:Fe3+、Ba2+、K+、NO3- | |
| B. | b点对应的溶液中大量存在:Na+、K+、NH4+、Cl- | |
| C. | d点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | c点对应的溶液中大量存在:CO32-、Na+、Cu2+、SO42- |
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲基中含有的电子数为10NA | |
| B. | 1mol乙醇中含有C-H键的数目为6NA | |
| C. | 300mL2mol/L乙醇水溶液中所含H原子数为3.6NA | |
| D. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
11.有7种物质:①乙烷②乙烯③乙炔④苯⑤甲苯⑥溴乙烷⑦聚丙烯,其中既不能使酸性KMnO4溶液褪色,也不能与溴水因发生化学反应而使溴水褪色的是( )
| A. | ①②③⑤ | B. | ①④⑥⑦ | C. | ②④⑥⑦ | D. | ②③④⑤ |
1.将铜片、锌片与稀硫酸设计成原电池,下列说法错误的是( )
| A. | 电子由锌片流出 | |
| B. | 锌比铜活泼,所以锌作正极 | |
| C. | 溶液中c(H+)减小 | |
| D. | 当有6.5g锌溶解时电路中转移的电子数是0.2NA |
5.下列各装置中能构成原电池的是( )
| A. | 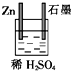 | B. | 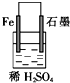 | C. | 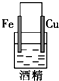 | D. |  |
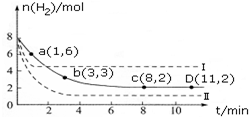 工业上研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:
工业上研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是: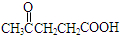 ,C为HOOC-COOH.A的红外光谱图和核磁共振氢谱图如图1:
,C为HOOC-COOH.A的红外光谱图和核磁共振氢谱图如图1: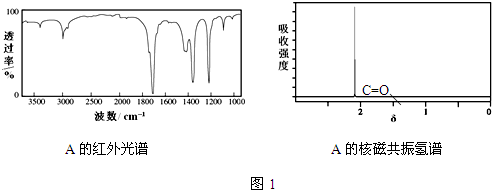

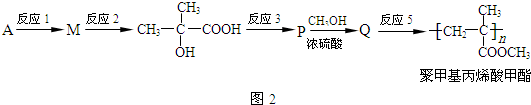
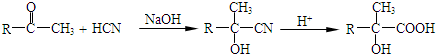
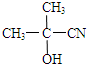 .
.