题目内容
【题目】物质A~G有如图所示转化关系(部分生成物没有列出).其中A是常见的金属单质,E、F是气体.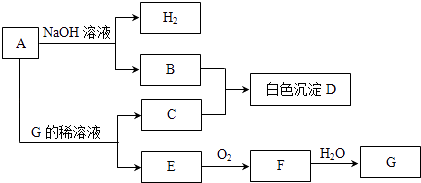
请回答下列问题:
(1)写出下列物质的化学式:A、D、G;
(2)B和C反应生成D的离子方程式为;
(3)A在碱性溶液中和NO3﹣反应时生成B和NH3 , 总反应的离子方程式为;
(4)相同条件下,向500mLE、F的混合气体中通入187.5mLO2 , 所有气体可恰好完全被水吸收生成G,则E和F的体积比为 .
(5)等体积的E、F通入NaOH溶液中可生成盐和水,反应的化学方程式为 . 室温下,0.1mol/L的上述盐溶液pH=8.3,原因是(用离子方程式表示)该溶液中所有离子按浓度由大到小排列的顺序为 .
【答案】
(1)A;Al(OH)3;HNO3
(2)Al3++3AlO2﹣+6H2O=4Al (OH)3↓
(3)4H2O+8Al+5OH﹣+3NO3﹣=3AlO2﹣+NH3↑
(4)1:3
(5)NO+NO2+2NaOH=2NaNO2+H2O;NO2﹣+H2O?HNO2+OH﹣;c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+)
【解析】解:(1)依据推断可知ADG分别为:Al,Al(OH)3 , HNO3;所以答案是:Al,Al(OH)3 , HNO3;(2)B和C反应生成D的反应是偏铝酸钠和硝酸铝在水溶液中发生的双水解反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2﹣+6H2O=4Al (OH)3↓;所以答案是:Al3++3AlO2﹣+6H2O=4Al (OH)3↓;(3)A在碱性溶液中和NO3﹣反应时生成B和NH3 , 总反应的离子方程式为4H2O+8Al+5OH﹣+3NO3﹣=3AlO2﹣+NH3↑;所以答案是:4H2O+8Al+5OH﹣+3NO3﹣=3AlO2﹣+NH3↑;(4)相同条件下,向500mLE、F的混合气体中通入187.5mLO2 , 所有气体可恰好完全被水吸收生成G,E为NO,F为NO2 , G为HNO3 , 气体在相同条件下,条件比等于物质的量之比,设NO为x,NO2为y,4NO+3O2+2H2O=4HNO3 , 4NO2+O2+2H2O=4HNO3 ,
x+y=500![]() +
+ ![]() =187.5
=187.5
x=125
y=375
则E和F的体积比为1:3,
所以答案是:1:3;(5)等体积的E、F通入NaOH溶液中可生成亚硝酸盐和水,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O;室温下,0.1mol/L的上述盐溶液pH=8.3,说明亚硝酸钠水解显碱性,NO2﹣+H2OHNO2+OH﹣;溶液中所有离子按浓度由大到小排列的顺序为c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+);所以答案是:NO+NO2+2NaOH=2NaNO2+H2O;NO2﹣+H2OHNO2+OH﹣;c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+);

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3 , 装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5和HCl,遇O2会生成POCl3 , POCl3溶于PCl3 , PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | ﹣112 | 75.5 |
PCl5 | 2 | 105.3 |
请回答下列问题
(1)装置中制氯气的离子方程式为
(2)B中的试剂是 , E中次冷水的作用是 , F中碱石灰的作用是
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2 , 再迅速加入黄磷.通干燥CO2的作用是通过控制K1、K2能除去A、B装置中的空气,具体的方法是
(4)粗产品含有POCl3、PCl3等,加入黄磷加热除去PCl5 , 通过(填实验操作的名称),即可得到纯净的PCl3
(5)通过下面方法可测定产品中PCl3的质量分数.①迅速称取100g产品,加水反应后配成250mL溶液;
②取以上溶液25.0mL,向其中加入0.1mol 10mL碘水,充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.1mol/L的Na2S2O3溶液滴定,滴定终点现象是
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.已知H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2SO4根据以上数据,该产品中PC3的质量分数是 .