题目内容
17.下列各组中的两种物质作用时,反应条件或反应物的用量比改变,不会引起产物种类改变的是( )| A. | Na与O2 | B. | NaOH与CO2 | C. | Na2O与CO2 | D. | Na2O2与H2O |
分析 A.钠与氧气反应条件不同产物不同;
B.二氧化碳与氢氧化钠发生反应,产物与用量有关;
C.氧化钠与二氧化碳反应只生成碳酸钠;
D.过氧化钠与水反应生成氢氧化钠和氧气.
解答 解:A.钠与氧气反应常温下生成氧化钠,加热生成过氧化钠,故A不选;
B.二氧化碳与氢氧化钠发生反应,产物与用量有关,二氧化碳少量生成碳酸钠,二氧化碳过量生成碳酸氢钠,故B不选;
C.氧化钠与二氧化碳反应只生成碳酸钠,与反应条件和反应物用量无关,故C选;
D.过氧化钠与水反应生成氢氧化钠和氧气,与反应条件和反应物用量无关,故D选;
故选:CD.
点评 本题考查了反应条件和反应物量的多少对反应产物的影响,掌握物质的性质是解题的关键.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
7.碳酸铜和碱式碳酸铜〔Cu2(OH)2CO3〕均可溶于盐酸,转化为氯化铜.在高温下这两种化合物均能分解生成氧化铜.溶解28.4g的上述混合物,消耗2mol•L-1的盐酸250mL.灼烧等量的上述混合物,得到氧化铜的质量是( )
| A. | 40 g | B. | 30 g | C. | 20 g | D. | 15 g |
8.向氯酸钠的酸性水溶液中通入二氧化硫,反应中氧化过程为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X可能是( )
| A. | ClO2 | B. | NaClO4 | C. | HClO | D. | NaClO |
12.一定量某物质的溶液,其质量分数为0.2A,当加入等体积的水稀释后,其质量分数小于0.1A,则该溶液的密度( )
| A. | 大于水的密度 | B. | 小于水的密度 | C. | 等于水的密度 | D. | 无法确定 |
2.下列表述中正确的是( )
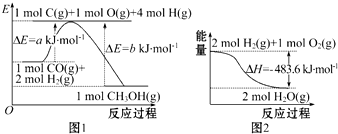

| A. | 根据图1可知合成甲醇的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者△H小 | |
| C. | 图2表示2 mol H2(g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
9.下列各离子组的叙述正确的是( )
| A. | 在强酸性条件下Na+、IO-、K+、可以大量共存 | |
| B. | 在强碱性条件下K+、AlO2-、Na+、NO3-可以大量共存 | |
| C. | 在水溶液中H+、NH4+、SiO32-、Cl-不能大量共存 | |
| D. | 在强酸性条件下NH4+、K+、SO32-、S2-可以大量共存 |
6.Co是γ放射源,Co可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种.对原子Co的叙述不正确的是( )
| A. | 质量数是60 | B. | 质子数是27 | C. | 中子数是33 | D. | 电子数是33 |
7.下列仪器使用正确的是( )
| A. | 使用漏斗、滤纸、玻璃棒等进行过滤实验 | |
| B. | 用带玻璃塞的试剂瓶盛盐酸 | |
| C. | 在表面皿蒸发浓缩NaCl溶液 | |
| D. | 配制100mL浓度为0.10 mol•L-1Na Cl溶液时,在容量瓶中溶解、定容 |