题目内容
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电过程中镉元素被氧化
B.充电时阳极反应:Ni(OH)2-e—+ OH—=== NiOOH + H2O
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH—向正极移动
【答案】B
【解析】
试题分析:A.充电过程中镉元素化合价降低被还原,因此A错误;B.充电时阳极反应:Ni(OH)2-e—+OH—===NiOOH+H2O,因此B正确C.放电时负极生成Cd(OH)2附近溶液的碱性减小,因此C错误;D.放电时电解质溶液中的阴离子向负极移动,因此D错误;

 步步高达标卷系列答案
步步高达标卷系列答案【题目】该同学用如下装置进行实验,分析影响反应速率的因素:
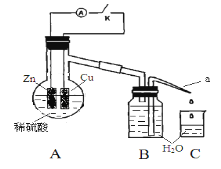
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示。下列说法不正确的是
实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
实验Ⅱ(闭合K))1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |
A. 实验Ⅰ中化学能主要转化为热能
B. 实验Ⅱ中化学能主要转化为电能
C. 反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率
D. 反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸 分子式:HCl 相对分子质量:36.5 密度约1.18 g·mL-1 HCl的质量分数:36.5% |
(1)该盐酸的物质的量浓度= ,从中取出100ml,所含HCl的物质的量为 ,所含Cl-的质量为 。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中C(HCl)= ,从中取出10ml,其浓度为 。
(3)取稀释后的盐酸与足量锌粒作用,生成是 。