题目内容
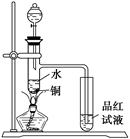
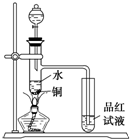
如图:在左边试管中加入2毫升95%的乙醇,并在摇动下缓缓加入2毫升浓硫酸,充分摇匀,冷却后再加入2克无水醋酸钠,用玻璃棒充分搅拌后,将试管固定在铁架台上;在右边的试管中加入5毫升饱和Na2CO3溶液,按右图的连接置,用酒精灯对左边的试管加热,当观察到右边的试管中有明显现象时,停止实验: 
(1)写出左边试管中的主要化学反应方程式_________
(2)加入浓硫的目的是____________________
(3)在右边试管中观察到的现象是__________________
(4)该实验中球形干燥管除起冷凝作用外,另一重要作用是____________________
(5)饱和Na2CO3溶液的主要作用是__________________________________.
10g固体成分为:碳酸钠和碳酸氢钠,其对应的氢氧化钠溶液浓度为1.73mol/L.
11.6 g固体成分为:碳酸钠和氢氧化钠,其对应的氢氧化钠溶液浓度为2.25mol/L.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证: