题目内容
15.从香料八角中提取的有机物A可制得抗禽流感病毒的特效药“达菲”.(1)经测定,A的相对分子质量在150~200之间,含碳的质量分数为48.3%,含氢的质量分数为5.7%,其余为氧.则A的分子式为C7H10O5.
(2)1molA能与足量NaHCO3反应得到标准状况下的CO2 22.4L,与足量金属钠反应得到标准状况下的H2 44.8L,能与1mol Br2发生加成反应.将A分子中含有官能团的名称及数目填入下表(可不填满也可补充):
| 官能团名称 | 羧基 | 羟基 | 碳碳双键 | 不填 |
| 官能团数目 | 1 | 1 | 1 | 不填 |
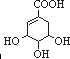 .
.
分析 (1)A的相对分子质量在150~200之间,含碳的质量分数为48.3%,含氢的质量分数为5.7%,含氧的质量分数为1-48.3%-5.7%=46.0%,以此计算C、H、O的原子个数之比,结合相对分子质量确定分子式;
(2)有机物不饱和度为$\frac{7×2+2-10}{2}$=3,1molA能与足量NaHCO3反应得到标准状况下的CO2 22.4L,说明含有1个羧基,与足量金属钠反应得到标准状况下的H2 44.8L,说明还还有3个羟基,能与1mol Br2发生加成反应,说明含有1个碳碳双键,结合不饱和度为3,可知应含有碳环;
(3)A与等物质的量的H2加成后生成B.B应为羧酸,A的红外光谱显示其分子中除了含有上述官能团外,还含有一个六元碳环,B的核磁共振氢谱显示其分子中有7种不同化学环境的氢原子.已知羟基连在双键碳原子上是不稳定的,两个羟基连在同一碳原子上也是不稳定的,说明羟基分别连接在不同碳原子上,且B结构对称.
解答 解:(1)A的相对分子质量在150~200之间,含碳的质量分数为48.3%,含氢的质量分数为5.7%,含氧的质量分数为1-48.3%-5.7%=46.0%,
则N(C):N(H);N(O)=$\frac{48.3%}{12}$:$\frac{5.7%}{1}$:$\frac{46%}{16}$=7:10:5,则最简式为C7H10O5,设分子式为(C7H10O5)n,则150<162n<200,n=1,则分子式为C7H10O5,
故答案为:C7H10O5;
(2)1molA能与足量NaHCO3反应得到标准状况下的CO2 22.4L,说明含有1个羧基,与足量金属钠反应得到标准状况下的H2 44.8L,说明还还有3个羟基,能与1mol Br2发生加成反应,说明含有1个碳碳双键,
故答案为:
| 官能团名称 | 羧基 | 羟基 | 碳碳双键 | |
| 官能团数目 | 1 | 1 | 1 |
 ,故答案为:
,故答案为: .
.点评 本题考查较为综合,涉及有机物结构、有机物的推断、官能团的性质、同分异构体的书写等,难度较大,注意把握题给信息以及有机物的官能团的性质.

 名校课堂系列答案
名校课堂系列答案| A. | 金属元素与非金属元素间只能形成离子键 | |
| B. | 非金属元素不可能形成离子化合物? | |
| C. | 离子化合物中可能有共价键? | |
| D. | 共价化合物中可能有离子键? |
2CH3OH(g)═CH3OCH3(g)+H2O(g)
完成下列填空:
(1)有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式
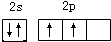 ;
;写出甲醇分子中官能团的电子式
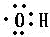 .
.(2)碳与同主族的短周期元素相比,非金属性较强的是C(填元素符号).写出一个能证明你的结论的化学方程式Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
(3)在温度和体积不变的情况下,能说明反应已达到平衡状态的是ac(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4)一定温度下,在三个体积约为2.0L的恒容密闭容器中发生上述反应:
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| Ⅱ | 387 | 0.80 | a | |
| Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
a.及时移走产物 b.升高温度 c.充入CH3OHd.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为$\frac{0.16}{t}$mol/(L.min)(用含t的式子表示).II号容器中a=0.32mol.
(5)若起始时向容器I中充入CH3OH 0.2mol、CH3OCH30.30mol和H2O 0.20mol,则反应将向正(填“正”“逆”)反应方向进行.
| A. | R一定是气态 | |
| B. | R一定是离子化合物 | |
| C. | R一定是共价化合物 | |
| D. | R可能是离子化合物,也可能是共价化合物 |
| A. | 苯的熔点比水的低、沸点比水的高 | B. | 苯的熔点比水的高、沸点比水的低 | ||
| C. | 苯的熔点、沸点都比水的高 | D. | 苯的熔点、沸点都比水的低 |
| A. | 加水振荡后用分液漏斗分离 | B. | 加溴水振荡后过滤 | ||
| C. | 加四氯化碳振荡后用分液漏斗分离 | D. | 加NaOH溶液振荡后用分液漏斗分离 |
| A. | 氢氧根离子的电子式: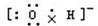 | B. | NH4Br的电子式: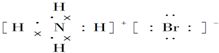 | ||
| C. | 四氯化碳的电子式: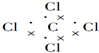 | D. | H2O的结构式:H-O-H |
| A. | 苯酚中滴加少量的稀溴水出现了1-溴苯酚的白色沉淀 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
| A. | 15 g甲基所含有的电子数是NA | |
| B. | 0.5 mol 1,3-丁二烯分子中含有碳碳双键的数目为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA | |
| D. | 常温常压下,1 mol丙烷所含有的共价键数目为12NA |