题目内容
5.设阿伏加德罗常数的数值为NA,则下列说法正确的是( )| A. | 15 g甲基所含有的电子数是NA | |
| B. | 0.5 mol 1,3-丁二烯分子中含有碳碳双键的数目为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA | |
| D. | 常温常压下,1 mol丙烷所含有的共价键数目为12NA |
分析 A、求出甲基的物质的量,然后根据甲基不显电性来分析;
B、根据 1,3-丁二烯是二烯烃来分析;
C、标况下,戊烷为液体;
D、1mol丙烷含10mol共价键来计算.
解答 解:A、15g甲基的物质的量n=$\frac{15g}{15g/mol}$=1mol,而甲基不显电性,故1mol甲基含9mol电子,即9NA个电子,故A错误;
B、1,3-丁二烯是二烯烃,故1mol1,3-丁二烯含2mol碳碳双键,则0.5mol1,3-丁二烯含1mol碳碳双键,即NA个,故B正确;
C、标况下,戊烷为液体,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、丙烷的分子式为C3H8,故1mol丙烷含10mol共价键,即10NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
相关题目
15.从香料八角中提取的有机物A可制得抗禽流感病毒的特效药“达菲”.
(1)经测定,A的相对分子质量在150~200之间,含碳的质量分数为48.3%,含氢的质量分数为5.7%,其余为氧.则A的分子式为C7H10O5.
(2)1molA能与足量NaHCO3反应得到标准状况下的CO2 22.4L,与足量金属钠反应得到标准状况下的H2 44.8L,能与1mol Br2发生加成反应.将A分子中含有官能团的名称及数目填入下表(可不填满也可补充):
(3)A与等物质的量的H2加成后生成B.A的红外光谱显示其分子中除了含有上述官能团外,还含有一个六元碳环,B的核磁共振氢谱显示其分子中有7种不同化学环境的氢原子.已知羟基连在双键碳原子上是不稳定的,两个羟基连在同一碳原子上也是不稳定的,则A的结构简式是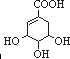 .
.
(1)经测定,A的相对分子质量在150~200之间,含碳的质量分数为48.3%,含氢的质量分数为5.7%,其余为氧.则A的分子式为C7H10O5.
(2)1molA能与足量NaHCO3反应得到标准状况下的CO2 22.4L,与足量金属钠反应得到标准状况下的H2 44.8L,能与1mol Br2发生加成反应.将A分子中含有官能团的名称及数目填入下表(可不填满也可补充):
| 官能团名称 | 羧基 | 羟基 | 碳碳双键 | 不填 |
| 官能团数目 | 1 | 1 | 1 | 不填 |
 .
.
13.据报道,在40GPa高压下,用激光器加热到1800K,科学家已成功合成出CO2原子晶体,下列有关这种CO2晶体推断正确的是( )
| A. | 易液化,可用作制冷材料 | |
| B. | CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合 | |
| C. | 硬度很大,可用作耐磨材料 | |
| D. | 在一定条件下,CO2分子晶体转化为原子晶体是物理变化 |
20.A+、B2-、C-三种离子具有相同的电子层结构,以下比较中正确的是( )
| A. | 原子半径B<C<A | B. | 原子序数A>B>C | ||
| C. | 离子半径B2->C->A+ | D. | 原子的电子总数C<A<B |
10.有机物CH2=CH-CH2-CH(OH)-COOH可发生下列反应中的哪几类( )
(1)使溴水褪色 (2)使高锰酸钾溶液褪色 (3)与钠反应 (4)加聚反应
(5)酯化反应 (6)水解反应 (7)取代反应.
(1)使溴水褪色 (2)使高锰酸钾溶液褪色 (3)与钠反应 (4)加聚反应
(5)酯化反应 (6)水解反应 (7)取代反应.
| A. | 除(7)外都可以 | B. | 除(6)外都可以 | C. | (1)(2)(3)(7) | D. | (1)(2)(3)(5) |
17.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 同周期第IA族元素与第ⅦA族元素形成的是离子化合物 | |
| C. | 硫化氢的沸点比水的沸点高 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
14.等质量的下列烃完全燃烧时,消耗氧气的量最多的是( )
| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C6H6 |
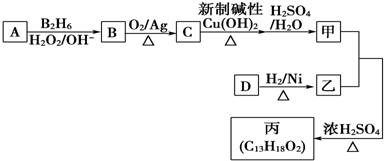
 ;
; ;
;