题目内容
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的结构式为________
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_________。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为_____,通入b气体的电极反应式_______.(质子交换膜只允许H+通过)

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
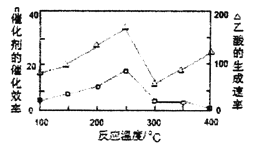
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在_________左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_________
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为________.
【答案】 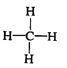 提供CH4分解所需的能量 负极 O2+4H++4e-=2H2O 250℃ 3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑ 1.6
提供CH4分解所需的能量 负极 O2+4H++4e-=2H2O 250℃ 3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑ 1.6
【解析】(1)甲烷为共价化合物,其结构为 ;正确答案:
;正确答案: 。
。
(2)甲烷高温分解生成氢气和碳,因此在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,可以为CH4分解提供所需的能量;正确答案:提供CH4分解所需的能量。
(3)由图可以知道,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极;通入b为氧气,获得电子,酸性条件下结合氢离子生成水,正极电极反应式为: O2+4H++4e-=2H2O ;正确答案:负极 ; O2+4H++4e-=2H2O 。
(4)①从图象可以知道:250℃时乙酸反应速率最大、催化活性高,故选择250℃;正确答案:250℃。
② CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为: 3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑;正确答案:3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑。
(5)根据得失电子守恒,则:![]() ,计算得出
,计算得出![]() ;正确答案:1.6。
;正确答案:1.6。

【题目】酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
(1)酸性锌锰干电池的负极反应为
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zng.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:①加入足量稀硫酸和溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为到之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.