题目内容
【题目】(1)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
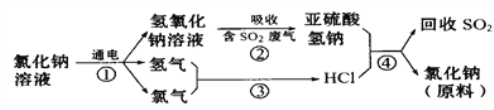
写出反应②的化学方程式______________________________。
(2)亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”的物质(该物质对人体有害),其结构简式为HOCH2SO3Na,根据其结构特点,可判断“吊白块”能发生的反应有________。
A.皂化反应 B.加聚反应 C.与金属钠反应 D.氧化反应
(3)近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油(用C5H12表示),试写出该反应的化学方程式____________________________________。
(4)煤的气化和液化属于______________(填“物理”或“化学”)变化。
(5)可燃冰属于新能源,我国是全球第一个成功稳定开采可燃冰的国家某种可燃冰(甲烷水合物)晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子或1个水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,则这种可燃冰的平均组成可表示为____________
(6)海水中溴含量为65mg·L-1。若1L 海水中有95%的溴元素被氧化为Br2 经热空气吹出,溴单质残留量为3%。最后用SO2 将90%的Br2 还原成Br-,所得溶液体积为50mL,则所得溶液中溴离子浓度为原海水中溴离子浓度的_____________倍(计算结果精确到0.1)。
【答案】 NaOH+SO2===NaHSO3 C、D 5CO2 +16 H2 ![]() C5H12 +10H2O 化学 CH4·8H2O 16.6
C5H12 +10H2O 化学 CH4·8H2O 16.6
【解析】(1)二氧化硫是酸性氧化物,能和少量强碱反应生成亚硫酸氢盐和水;
(2)吊白块中含有醇羟基、亚硫酸根离子,具有醇和亚硫酸盐性质;
(3)二氧化碳和氢气反应生成C5H12和水;
(4)有新物质生成为化学变化,无新物质生成为物理变化;
(5)根据题中关于天然气水合物构成的描述,判断天然气水合物的平均组成的表示式;
(6)根据c=![]() 计算物质的量浓度。
计算物质的量浓度。
(1)二氧化硫是酸性氧化物,能和少量强碱反应生成亚硫酸氢盐和水,反应方程式为NaOH+SO2===NaHSO3;因此,本题正确答案是: NaOH+SO2===NaHSO3;
(2)吊白块中含有醇羟基、亚硫酸根离子,具有醇和亚硫酸盐性质,能和钠反应生成氢气,能被强氧化剂氧化而发生氧化反应,不含酯基和碳碳不饱和键,所以不能发生皂化反应、聚合反应,所以C 、D选项是正确的。
(3)二氧化碳和氢气反应生成C5H12和水,化学方程式为:5CO2 +16 H2 ![]() C5H12 +10H2O;
C5H12 +10H2O;
(4)煤的气化和液化有新物质生成,属于化学变化;
(5)平均每46个水分子构成8个笼,晶体中每8个笼中有6个容纳了CH4分子,另外2个被2个游离的H2O分子所填充,天然气水合物的构成中含6个CH4分子、46+2=48个H2O分子,则CH4分子与H2O分子粒子数比= 6:48 = 1:8,则天然气水合物的平均组成可表示为CH4·8H2O;
(6)由题意可知,海水中溴离子浓度约为![]() =8.1×10—4mol/L,海水中溴含量很低,若将海水中溴离子氧化为Br2,经热空气吹出,再用SO2将Br2还原成Br-,可以提高溶液中溴离子浓度,起到富集的作用;所得溶液中溴离子浓度约为
=8.1×10—4mol/L,海水中溴含量很低,若将海水中溴离子氧化为Br2,经热空气吹出,再用SO2将Br2还原成Br-,可以提高溶液中溴离子浓度,起到富集的作用;所得溶液中溴离子浓度约为![]() =1.3×10—2mol/L,则得溶液中溴离子浓度为海水中溴离子浓度的
=1.3×10—2mol/L,则得溶液中溴离子浓度为海水中溴离子浓度的![]() =16.6倍。
=16.6倍。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案