题目内容
【题目】数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果. 已知:C(s)+O2(g)=CO2(g);△H=﹣393kJmol﹣1
2CO (g)+O2(g)=2CO2(g);△H=﹣566kJmol﹣1
2H2(g)+O2(g)=2H2O(g);△H=﹣484kJmol﹣1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 .
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为 .
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到. 第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>0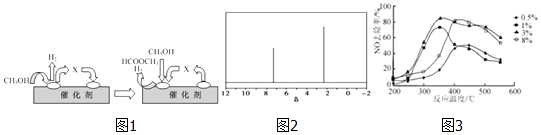
①第一步反应的机理可以用图1表示:图中中间产物X的结构简式为 .
②以甲醇制一氧化碳的反应为反应(填“吸热”、“放热”).
(4)天然气可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为 .
(5)C2H4可用于烟气脱硝.为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如3图所示.为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是 .
【答案】
(1)C(s)+H2O(g)═CO (g)+H2(g)△H=+132 kJ?mol﹣1
(2)让部分炭燃烧,提供炭与水蒸气反应所需要的热量; CO+2H2![]() CH3OH
CH3OH
(3)HCHO;吸热
(4)![]()
(5)350℃左右、3%
【解析】解:(1)已知:①C(s)+O2(g)=CO2(g);△H=﹣393kJmol﹣1
②2CO (g)+O2(g)=2CO2(g);△H=﹣566kJmol﹣1
③2H2(g)+O2(g)=2H2O(g);△H=﹣484kJmol﹣1
将(①×2﹣②﹣③)× ![]() 得到反应C(s)+H2O(g)=CO (g)+H2(g),则△H═(﹣393kJmol﹣1×2+566kJmol﹣1+484kJmol﹣1)×
得到反应C(s)+H2O(g)=CO (g)+H2(g),则△H═(﹣393kJmol﹣1×2+566kJmol﹣1+484kJmol﹣1)× ![]() =+132 kJmol﹣1
=+132 kJmol﹣1
所以答案是:C(s)+H2O(g)=CO(g)+H2(g)△H=+132 kJmol﹣1(2)根据(1)煤和水蒸气的反应生成一氧化碳和氢气要吸热,故喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量,
一氧化碳和氢气在一定条件下合成甲醇的原理为:CO+2H2![]() CH3OH,所以答案是:让部分炭燃烧,提供炭与水蒸气反应所需要的热量;CO+2H2
CH3OH,所以答案是:让部分炭燃烧,提供炭与水蒸气反应所需要的热量;CO+2H2![]() CH3OH(3)①依据图示和分解反应过程,结合原子守恒可知,甲醇去氢后得到的是甲醛,化学式为HCHO,
CH3OH(3)①依据图示和分解反应过程,结合原子守恒可知,甲醇去氢后得到的是甲醛,化学式为HCHO,
所以答案是:HCHO
②∵第一步:2CH3OH(g)═HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)═CH3OH(g)+CO(g)△H>0
∴第一步+第二步得:CH3OH(g)═2H2(g)+CO(g)△H>0,故反应吸热,
所以答案是:吸热(4)芳香烃X的相对分子质量为l06,设其分子式为CxHy,由 ![]() =8…10=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置,则X的结构简式为
=8…10=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置,则X的结构简式为 ![]() ,
,
所以答案是: ![]() ;(5)满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃左右,3%,
;(5)满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃左右,3%,
所以答案是:350℃左右、3%
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为![]() 、
、![]() 和
和![]() )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:
①![]()
②![]()
③![]()
回答下列问题:
化学键 |
|
| (CO)中的 |
|
|
|
|
|
|
|
|
(1)已知反应①中的相关的化学键键能数据如下:由此计算![]() ________
________ ![]() .
. ![]() ,已知
,已知![]() .
. ![]() ,则
,则![]() ________
________ ![]() .
. ![]()
(2)反应①的化学平衡常数![]() 的表达式为________;图
的表达式为________;图![]() 中能正确反映平衡常数
中能正确反映平衡常数![]() 随温度变化关系的曲线为________(填曲线标记字母),其判断理由是_____________________________.
随温度变化关系的曲线为________(填曲线标记字母),其判断理由是_____________________________.
(3)合成气的组成![]() 时体系中的
时体系中的![]() 平衡转化率
平衡转化率![]() 与温度和压强的关系如图
与温度和压强的关系如图![]() 所示.
所示. ![]() 值随温度升高而________(填“增大”或“减小”),其原因是_________________.图
值随温度升高而________(填“增大”或“减小”),其原因是_________________.图![]() 中的压强由大到小为________,其判断理由是____________________________________________
中的压强由大到小为________,其判断理由是____________________________________________