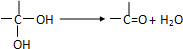
题目内容
8.铁矿石是重要的金属矿物资源,我省攀西地区有丰富的钒钛磁铁矿.(1)在自然界中,钛(Ti)、钒(V)存在多种核素,其中${\;}_{22}^{50}$Ti与${\;}_{23}^{50}$TV相同的是C.
A.质子数 B.中子数 C.质量数 D.核外电子数
(2)通过下列方法可以测定磁铁矿中铁的含量:将磁铁矿溶于较浓的盐酸中,用SnCl2将Fe3+还原为Fe2+,最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+.
①磁铁矿中Fe3O4溶于盐酸时发生反应的离子方程式为Fe3O4+8H+═Fe2++2Fe3++4H2O.
②配平K2Cr2O7溶液滴定FeCl2溶液时发生反应的离子方程式:
6Fe2++1 Cr2O${\;}_{7}^{2-}$+14H+═6Fe3++2Cr3++7H2O
③现有磁铁矿样品0.500 g,经上述各步反应后,共用去0.0200 mol/L的K2Cr2O7溶液24.5 mL.计算该样品中铁的质量分数(计算结果保留1位小数).
分析 (1)元素符号左下角数字表示质子数、左上角数字表示质量数,中子数=质量数-质子数,原子中核外电子数=质子数;
(2)①磁铁矿中Fe3O4溶于盐酸时生成氯化铁、氯化亚铁和水;
②该反应中Fe元素化合价由+2价变为+3价,Cr元素化合价由+6价变为+3价,根据转移电子守恒、原子守恒、电荷守恒配平方程式;
③根据亚铁离子和K2Cr2O7之间的化学式计算亚铁离子物质的量,再根据m=nM计算Fe元素质量,从而计算其质量分数.
解答 解:(1)元素符号左下角数字表示质子数、左上角数字表示质量数,中子数=质量数-质子数,原子中核外电子数=质子数,
A.二者质子数分别是22、23,所以不同,故错误;
B.二者中子数分别是28、27,所以不同,故错误;
C.二者质量数都是50,所以相同,故正确;
D.二者核外电子数分别是22、23,所以不同,故错误;
故选C;
(2)①磁铁矿中Fe3O4溶于盐酸时生成氯化铁、氯化亚铁和水,离子方程式为Fe3O4+8H+═Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+═Fe2++2Fe3++4H2O;
②该反应中Fe元素化合价由+2价变为+3价,Cr元素化合价由+6价变为+3价,根据转移电子守恒、原子守恒、电荷守恒配平方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6;1;14;6;2;7;
③解:设滴定Fe2+消耗K2Cr2O7的物质的量为x.
6Fe2+--Cr2O72-
6 mol 1 mol
x 0.0200 mol•L-1×0.0245 L
x=0.0200 mol•L-1×0.0245 L×6=0.0294 mol,
磁铁矿样品中铁的质量分数为 $\frac{0.0294mol×56g/mol}{0.500g}$×100%=32.9%,
答:铁元素质量分数是32.9%.
点评 本题考查氧化还原反应方程式的配平、氧化还原反应的计算等知识点,根据转移电子守恒配平方程式,根据物质之间的关系式进行计算,熟悉常见元素化合价,题目难度不大.

| A. | 乙醇中的水:CaO,蒸馏 | B. | 乙酸乙酯中的乙酸:NaOH溶液,分液 | ||
| C. | 乙醇中的苯酚:溴水,过滤 | D. | 乙烷中的乙烯:溴水,分液 |
| A. | 海洋中有丰富的潮汐能、波浪能等新型能源 | |
| B. | 海水蒸发制海盐的过程是化学变化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
| A. | 乙酸乙酯的制备实验中,用饱和氢氧化钠溶液来吸收随乙酸乙酯蒸出的少量乙酸和乙醇 | |
| B. | 甲烷跟氯气反应生成的CH3Cl、CH2Cl2、CHCl3、CCl4均为不溶于水的油状液体 | |
| C. | 石油的蒸馏,温度计的水银球必须插入反应液液面以下 | |
| D. | 水与金属钠反应比乙醇与金属钠反应更剧烈 |
| A. | 溴苯中混有溴,加入氢氧化钠溶液后分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 |
| 实验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和NaHCO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现白色沉淀 |

 .
. .
.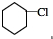 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$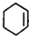 +NaCl+H2O.
+NaCl+H2O. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图.
)的合成路线示意图.