题目内容
氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2+3H2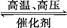 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式 。
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知该反应的ΔS="-198.2" J·K-1·mol-1。则上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。
(1)N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" mol·L-1
2NH3(g) ΔH="-92.4" mol·L-1
(2)能
解析

甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g) △H1
2CO (g) +O2(g) =2CO2(g) △H2
2H2(g)+O2(g) =2H2O(g) △H3
则 CO(g) + 2H2(g)  CH3OH(g) 的△H= 。
CH3OH(g) 的△H= 。
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
(4)CH4和H2O在催化剂表面发生反应CH4+H2O
 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
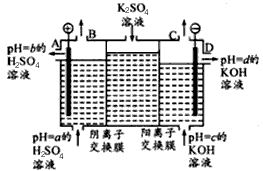
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的 传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极的电极反应式为 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole- 时,实际上消耗的甲醇的质量比理论上大,可能原因是 。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀 (填“能”或“否”)。
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答(1)~(5)题。
(1)下列物质本身具有的能量最低的是 。
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是 。
A.HCl B.HBr C.HI
(3)X2+H2
 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。 (4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答: ,你的根据是 ______________________。
研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)?n(HSO3-)变化关系如下表:
| n(SO32-)?n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是 __。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(3)若某溶液中含3 mol Na2SO3,逐滴滴入一定量稀HCl,恰好使溶液中Cl-与HSO3-物质的量之比为2?1,则滴入盐酸中n(HCl)为 __mol。
Ⅱ.CO可用于合成甲醇,反应原理为
CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。(4)在容积为2 L的密闭容器中通入0.2 mol CO,0.4 mol H2,达到平衡时,CO转化率为50%,则该温度下的平衡常数为 __,再加入1.0 mol CO后,重新达到平衡,CO的转化率 __(填“填大”“不变”或“减小”);平衡体系中CH3OH的体积分数 __(填“增大”“不变”或“减小”)。
(5)已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g);
H2(g)+
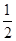 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。有关键能数据如下:(单位:kJ/mol)
| 化学键 | H—H | H—O | C—H | C—O | C=O |
| 键能 | 435 | 463 | 413 | 356 | 745 |
写出甲醇气体完全燃烧生成气态水的热化学方程式: __。
 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出 kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出 kJ能量。
 2CO2(g)+ N2(g) △H<0,
2CO2(g)+ N2(g) △H<0,
 N2O4(g) ΔH=-56.9 kJ/mol ②
N2O4(g) ΔH=-56.9 kJ/mol ② 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
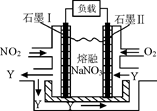
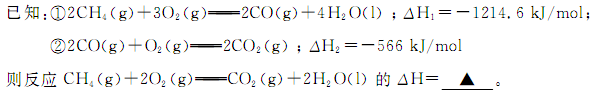
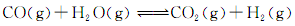 ,得到如下三组数据:
,得到如下三组数据: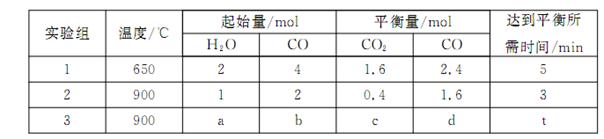
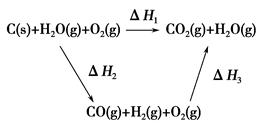
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: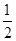 O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1