题目内容
研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)?n(HSO3-)变化关系如下表:
| n(SO32-)?n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是 __。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
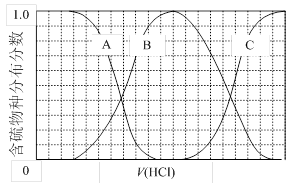
(3)若某溶液中含3 mol Na2SO3,逐滴滴入一定量稀HCl,恰好使溶液中Cl-与HSO3-物质的量之比为2?1,则滴入盐酸中n(HCl)为 __mol。
Ⅱ.CO可用于合成甲醇,反应原理为
CO(g)+2H2(g)
 CH3OH(g)。
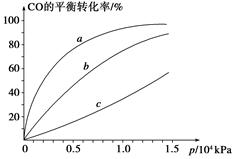
CH3OH(g)。(4)在容积为2 L的密闭容器中通入0.2 mol CO,0.4 mol H2,达到平衡时,CO转化率为50%,则该温度下的平衡常数为 __,再加入1.0 mol CO后,重新达到平衡,CO的转化率 __(填“填大”“不变”或“减小”);平衡体系中CH3OH的体积分数 __(填“增大”“不变”或“减小”)。
(5)已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g);
H2(g)+
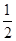 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。有关键能数据如下:(单位:kJ/mol)
| 化学键 | H—H | H—O | C—H | C—O | C=O |
| 键能 | 435 | 463 | 413 | 356 | 745 |
写出甲醇气体完全燃烧生成气态水的热化学方程式: __。
(1)酸 HSO3-电离趋势大于水解趋势
(2)ab
(3)4
(4)100 L2/mol-2 减小 减小
(5)CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH=-536.4 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-536.4 kJ/mol
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s) +O2(g) =2CO(g) △H= 。
(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<O测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如图所示:
CH3OH(g)+H2O(g) △H<O测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如图所示: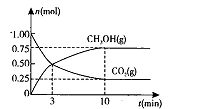
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3)CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 | H2CO3 | NH3.H2O |
| 电离平衡常数( 25℃) | Ka1 = 4.30 × 10一7 Ka2= 5.61× 10一11 | Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知:
 水解的平衡常数Kh=Kw/Kb,
水解的平衡常数Kh=Kw/Kb,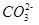
第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中
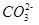 发生第一步水解的离子方程式 。
发生第一步水解的离子方程式 。②下列粒子之间的关系式,其中正确的是 。
A.
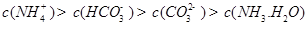
B.

C.
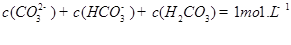
D.
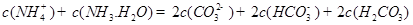
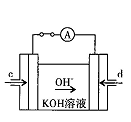
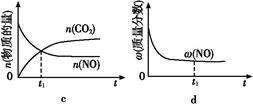
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式: 。
根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)=TiCl4(l)ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)=2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)=Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH=________ kJ·mol-1。
(2)已知下列反应数值:
| 反应序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
| ② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol- |
| ③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
| ④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4=____________ kJ·mol-1。
 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。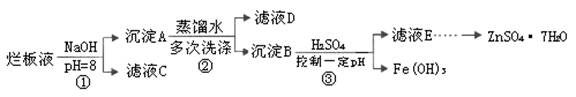
 Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1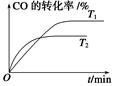

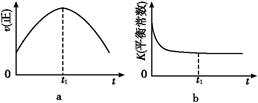
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
 N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol N2O4(g) ΔH2="-56.9" kJ/mol
N2O4(g) ΔH2="-56.9" kJ/mol
 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。


 ,△H=__________kJ
,△H=__________kJ (用含a、b、c、d的式子表示)。
(用含a、b、c、d的式子表示)。
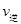 (CO)___________B点的逆反应速率
(CO)___________B点的逆反应速率